
Alle iLive-Inhalte werden medizinisch überprüft oder auf ihre Richtigkeit überprüft.
Wir haben strenge Beschaffungsrichtlinien und verlinken nur zu seriösen Medienseiten, akademischen Forschungseinrichtungen und, wenn möglich, medizinisch begutachteten Studien. Beachten Sie, dass die Zahlen in Klammern ([1], [2] usw.) anklickbare Links zu diesen Studien sind.
Wenn Sie der Meinung sind, dass einer unserer Inhalte ungenau, veraltet oder auf andere Weise bedenklich ist, wählen Sie ihn aus und drücken Sie Strg + Eingabe.
Syndrom der ovariellen Überstimulation
Facharzt des Artikels
Zuletzt überprüft: 05.07.2025
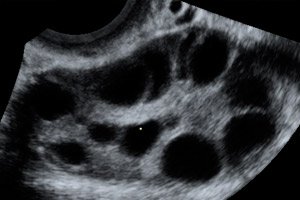
Das ovarielle Hyperstimulationssyndrom (OHSS) ist eine iatrogene Komplikation, die auf der hyperergen, unkontrollierten Reaktion der Eierstöcke auf die Verabreichung von Gonadotropinen in Ovulationsstimulationszyklen und Programmen zur assistierten Reproduktionstechnologie beruht.
Das Syndrom kann sich nach der Ovulationsinduktion mit Clomifen oder zu Beginn einer Schwangerschaft in einem spontanen Zyklus manifestieren.
 [ 1 ]
[ 1 ]
Epidemiologie
Die Inzidenz des ovariellen Überstimulationssyndroms variiert je nach Stimulationsschemata zwischen 0,5 und 14 % und nimmt nicht ab. Die Erkrankung weist unterschiedliche Schweregrade auf und kann aufgrund thromboembolischer Komplikationen oder eines akuten Syndroms (ARDS) tödlich verlaufen. Die erwartete Sterblichkeitsrate liegt bei 1 von 450.000 bis 500.000 Frauen. Schwere Formen des Syndroms, die einen stationären Aufenthalt auf der Intensivstation erfordern, treten in 0,2–10 % der Fälle auf. Laut dem russischen Nationalen Register für Methoden der assistierten Reproduktionstechnologie lag die Inzidenz des schweren OHSS im Jahr 2004 bei 5,6 %.
Ursachen des ovariellen Überstimulationssyndroms
Risikofaktoren für die Entwicklung eines ovariellen Überstimulationssyndroms:
- Alter unter 35 Jahren,
- asthenischer Körperbau,
- das Vorhandensein von polyzystischen oder multifollikulären Eierstöcken,
- Reifung von mehr als zehn Follikeln im Ovulationsstimulationsprotokoll,
- Einnahme von Gonadotropin-Releasing-Hormon-Agonisten und hohen Dosen von Gonadotropinen,
- der Beginn der Schwangerschaft,
- Unterstützung der Lutealphase mit hCG-Präparaten,
- allergische Erkrankungen.
Wie entsteht ein ovarielles Überstimulationssyndrom?
Das ovarielle Überstimulationssyndrom tritt vor dem Hintergrund einer ungewöhnlich hohen Konzentration von Sexualhormonen im Blutplasma auf und beeinträchtigt die Funktionen verschiedener Körpersysteme, vor allem der Eierstöcke, negativ. Es ist durch eine Vergrößerung der Eierstöcke, manchmal bis zu einem Durchmesser von 20–25 cm, gekennzeichnet, mit der Bildung von Follikel- und Lutealzysten vor dem Hintergrund eines ausgeprägten Stromaödems. Auslöser für die Entwicklung des Syndroms ist die Gabe einer ovulatorischen Dosis Choriongonadotropin. Die Entwicklung des Syndroms basiert auf dem Phänomen der „erhöhten Gefäßpermeabilität“, die zu einer massiven Freisetzung proteinreicher Flüssigkeit in den dritten Raum, das Interstitium, und dessen Ablagerung mit der Entwicklung von Hypovolämie, Hämokonzentration, Oligurie, Hypoproteinämie, Elektrolytstörungen, erhöhter Aktivität von Leberenzymen, der Bildung von Aszites, Hydrothorax, Hydroperikard mit oder ohne hypovolämischen Schock führt. Der „Faktor X“, der die Flüssigkeitstranssudation verursacht, ist jedoch noch unbekannt. In schweren Fällen treten Anasarka, akutes Nierenversagen, thromboembolische Komplikationen und ARDS auf.
Derzeit wird das ovarielle Überstimulationssyndrom aus der Perspektive des SIRS betrachtet, vor dessen Hintergrund massive Endothelschäden auftreten. Bei Patientinnen mit OHSS wurden im Peritonealtranssudat hohe Konzentrationen von Interleukinen (IL-1, IL-2, IL-6, IL-8) und Tumornekrosefaktoren (TNF-α, TNF-(3)) nachgewiesen, die die Prostaglandinsynthese in den Ovarien, die ovarielle Neovaskularisation und die Gefäßpermeabilität verstärken. Unter dem Einfluss proinflammatorischer Zytokine kommt es zu einer systemischen Aktivierung von Gerinnungsprozessen. Das Ausmaß der Leukozytose korreliert mit dem Schweregrad des SIRS. Die organsystemischen Schäden beim OHSS ähneln denen bei einer Sepsis. Die Rolle des mikrobiellen Faktors beim OHSS und sein Beitrag zur Entstehung eines SIRS werden derzeit diskutiert. Man geht davon aus, dass Mikroorganismen, die den Darm und den Urogenitaltrakt besiedeln, über ihren Lebensraum hinaus vordringen und dort ähnliche Auswirkungen auf den Körper haben können wie bei einer Sepsis.
Symptome des ovariellen Überstimulationssyndroms
Die Schwere des Syndroms hängt direkt mit der Schwere der hämodynamischen Störungen zusammen, die das klinische Bild verursachen. Das Syndrom kann allmählich mit zunehmenden Symptomen oder plötzlich (akut) auftreten, wobei es innerhalb weniger Stunden zu einer starken Umverteilung von Flüssigkeit im Körper mit Ansammlung in den serösen Hohlräumen kommt. Wenn sich das Syndrom manifestiert, treten Beschwerden wie Schwäche, Schwindel, Kopfschmerzen, flackernde „Fliegen“ vor den Augen, Kurzatmigkeit in Ruhe und bei körperlicher Anstrengung, trockener Husten, der sich in liegender Position verstärkt, trockener Mund, Übelkeit, Erbrechen, Durchfall, Blähungen, Völlegefühl, Anspannung, Bauchschmerzen oft ohne klare Lokalisierung, seltenes Wasserlassen, Fieber, Schwellung der äußeren Genitalien und der unteren Extremitäten auf.
Bei Patienten mit ovariellem Überstimulationssyndrom kann sich aufgrund eingeschränkter Lungenbeweglichkeit aufgrund von Aszites, vergrößerten Eierstöcken oder Pleuraerguss ein Atemversagen entwickeln. Der Verlauf eines schweren OHSS im Manifestationsstadium kann durch akuten Hydrothorax, ARDS, Lungenembolie, Lungenembolie, Atelektase und intraalveoläre Blutungen kompliziert werden. Ein Pleuraerguss wird bei etwa 70 % der Frauen mit mittelschwerem bis schwerem OHSS diagnostiziert. Der Erguss kann ein- oder beidseitig sein und vor dem Hintergrund von Aszites auftreten. Bei OHSS wurden Verschiebungen und Kompressionen der Mediastinalorgane aufgrund eines massiven rechtsseitigen Pleuraergusses mit Schockentwicklung sowie ein tödlicher Ausgang bei einer Frau mit OHSS und Hydrothorax aufgrund von Atelektase und massiver Blutung in das Alveolarlumen beschrieben.
Hämodynamische Störungen. Bei mittelschwerem und schwerem OHSS treten arterielle Hypotonie und Tachykardie auf.
Aszites. Der Bauch ist aufgetrieben, oft angespannt, schmerzhaft in allen Bereichen, aber häufiger im Unterbauch in der Projektion der Eierstöcke.
Nieren- und Leberfunktionsstörungen. Es werden Harnverhalt, Oligurie, Anurie und Hepatomegalie beobachtet.
Der Verlauf des OHSS geht bei 80 % der Patienten mit einer schweren Form des Syndroms mit Fieber einher. Bei 20 % der Frauen tritt Fieber vor dem Hintergrund einer Harnwegsinfektion auf, bei 3,8 % aufgrund einer Lungenentzündung und bei 3,3 % aufgrund einer Infektion der oberen Atemwege. Eine Thrombophlebitis durch die Anlage eines intravenösen Katheters verursacht bei 2 % Fieber, eine Entzündung des Unterhautfettgewebes an der Punktionsstelle der Bauchdecke während einer Laparozentese bei 1 % der Patienten. Eine Infektion der Operationswunde tritt bei 1 % auf, Abszesse nach der Injektion (intramuskuläre Gabe von Progesteron) bei 0,5 %. Fieber nicht-infektiöser Genese bei jedem zweiten Patienten mit OHSS ist wahrscheinlich mit endogenen pyrogenen Mechanismen verbunden. Es wurden vereinzelte Fälle von Sepsis bei schwerem OHSS beschrieben.
Vor dem Hintergrund der Entwicklung des Syndroms kommt es zu einer Verschlimmerung latenter chronischer somatischer Erkrankungen.
Was bedrückt dich?
Einstufung
Es gibt keine einheitliche Klassifizierung des ovariellen Überstimulationssyndroms. Basierend auf klinischen und laborchemischen Symptomen werden vier Schweregrade des Syndroms unterschieden:
- Leichtes OHSS. Bauchschmerzen, Eierstöcke mit einem Durchmesser von bis zu 8 cm mit oder ohne Zysten, Laborwerte sind normal. Ein leichtes OHSS wird als „kontrollierte ovarielle Überstimulation“ bezeichnet, da dieser Zustand in absolut allen Zyklen der Superovulationsstimulation beobachtet wird und derzeit nicht als behandlungsbedürftiges pathologisches Syndrom gilt.
- Mäßiges OHSS. Mäßige Schmerzen in allen Teilen des Bauches, Übelkeit, Erbrechen, Durchfall, Eierstöcke mit einem Durchmesser von 8–12 cm mit Zysten, Ultraschall und/oder klinische Anzeichen von Aszites, Hämatokrit nicht über 45 %, Leukozytose – 10–16 x 10 9 /l, Hyperkoagulation (D-Dimer – mehr als 0,5 μg/ml, Fibrinogenkonzentration – mehr als 400 mg/dl, APTT, INR – im Normbereich).
- Schweres OHSS. Hämatokrit über 45 %, Leukozytose 17-24x10 9 /l, Hyperkoagulation (D-Dimer über 5 μg/ml, Fibrinogen über 600 mg/dl), Eierstöcke über 12 cm Durchmesser mit Zysten, alle klinischen und laborchemischen Anzeichen eines mittelschweren OHSS und gespannter Aszites, Hydrothorax, Leberfunktionsstörung, Oligurie [Diurese weniger als 0,5 ml/(kg h)].
- Kritisches OHSS. Hämatokrit über 55 %, Leukozytose über 25 x 109/l, gespannter Aszites, bilateraler Hydrothorax, Hydroperikardium, Anasarka, vergrößerte Ovarien bis zu 20–25 cm, Oligurie oder Anurie, akutes Nierenversagen, thromboembolische Komplikationen, ARDS.
Das ovarielle Überstimulationssyndrom wird ebenfalls in ein frühes und ein spätes Syndrom unterteilt.
Tritt ein OHSS in der Lutealphase auf und kommt es nicht zur Einnistung, verschwindet das Syndrom plötzlich und spontan mit Beginn der Menstruation und nimmt selten eine schwere Form an. Kommt es zur Einnistung, verschlechtert sich der Zustand der Patientin meist in den ersten 12 Schwangerschaftswochen. Ein spätes OHSS wird durch einen signifikanten Anstieg des hCG-Spiegels im Blutplasma verursacht und ist meist mit der Einnistung und einer frühen Schwangerschaft verbunden.
Folgen und Komplikationen
Komplikationen des ovariellen Überstimulationssyndroms können mit der Entwicklung thromboembolischer Komplikationen einhergehen. Die Ursache der Thrombose bei OHSS ist unbekannt, aber die Hauptrolle in der Pathogenese dieser Erkrankung wird hohen Konzentrationen von Sexualhormonen, entzündungsfördernden Zytokinen, Hämokonzentration und einem verringerten VCP zugeschrieben. Lange Krankenhausaufenthalte, eingeschränkte motorische Aktivität, verminderter venöser Rückfluss aufgrund vergrößerter Eierstöcke, erhöhte Aktivität von Gerinnungsfaktoren, Fibrinolysehemmern und Thrombozyten tragen zusätzlich zum hohen Risiko für die Entwicklung thrombotischer Komplikationen im Zusammenhang mit OHSS bei. Es wurde nachgewiesen, dass bei 84 % der Patientinnen mit thromboembolischen Komplikationen, die nach Eisprunginduktion und in Programmen zur assistierten Reproduktion auftraten, diese vor dem Hintergrund einer Schwangerschaft auftraten. In 75 % der Fälle wurde eine Thrombusbildung im Venenbett beobachtet, mit einer vorherrschenden Lokalisation in den Gefäßen der oberen Extremitäten, des Halses und des Kopfes (60 %). Bei einer Reihe von Patienten wurde eine spontane arterielle Thrombose in den Hirngefäßen diagnostiziert. Seltener wurden Thromben in den Arteria femoralis, poplitea, carotis, subclavia, iliaca, ulnaris, mesenterialen Arterien und der Aorta beobachtet. In der Literatur wird die Entwicklung eines Verschlusses der zentralen Netzhautarterie mit Sehverlust bei OHSS beobachtet. Die Inzidenz einer Lungenembolie bei Patienten mit OHSS und tiefer Venenthrombose der unteren Extremitäten beträgt 29 %, während bei Frauen mit OHSS und tiefer Venenthrombose der oberen Extremitäten und arterieller Thrombose das Risiko dieser Komplikation deutlich geringer ist und bei 4 bzw. 8 % liegt.
Schwere Fälle des ovariellen Überstimulationssyndroms können mit Komplikationen einhergehen, die einen chirurgischen Eingriff erfordern – Ruptur einer Eierstockzyste und intraabdominale Blutungen, Torsion der Gebärmutteranhänge, Eileiterschwangerschaft.
Diagnose des ovariellen Überstimulationssyndroms
Die Diagnose des ovariellen Überstimulationssyndroms wird auf der Grundlage von Anamnesedaten sowie einer umfassenden klinischen, labortechnischen und instrumentellen Untersuchung gestellt, die vergrößerte Eierstöcke mit mehreren Zysten, ausgeprägte Hämokonzentration und Hyperkoagulation bei einer Patientin aufdeckt, die in diesem Zyklus assistierte Reproduktionstechnologien oder eine kontrollierte Ovulationsinduktion verwendet hat, um eine Schwangerschaft zu erreichen.
Laborforschung
Klinischer Bluttest
Hämatokrit über 40 %, Hämoglobinkonzentration über 140 g/l, Leukozytose bis 50x10 9 /l ohne Linksverschiebung, Thrombozytose bis 500-600x10 6 /l. Eine Hämokonzentration (Hämatokrit über 55 %) weist auf eine potenzielle Lebensgefahr hin.
Biochemischer Bluttest
Elektrolytstörungen, einschließlich Hyperkaliämie (mehr als 5,3 mmol/l) und Hyponatriämie (mehr als 135 mmol/l), was zu einer verringerten Plasmaosmolarität führt. Hypoproteinämie (Gesamtprotein mehr als 66 g/l), Hypoalbuminämie (Albumin weniger als 35 g/l), hohes C-reaktives Protein, erhöhte Lebertransaminasen bis zu 800 U/l, in einigen Fällen erhöhte GGT oder alkalische Phosphatase, bei einigen Patienten - erhöhte Kreatininkonzentration mehr als 80 μmol/l und Harnstoff mehr als 8,3 mmol/l.
 [ 20 ], [ 21 ], [ 22 ], [ 23 ]
[ 20 ], [ 21 ], [ 22 ], [ 23 ]
Koagulogramm
Erhöhte Fibrinogenwerte über 400 mg/dl, von-Willebrand-Faktor über 140 %, erniedrigte Antithrombin-III-Konzentrationen unter 80 %, D-Dimer über 0,5 mcg/ml. Normalwerte für APTT, PTI, INR.
 [ 24 ]
[ 24 ]
Blutimmunglobuline
Verminderte Konzentration von IgG und IgA im Blutplasma. Allgemeine Urinanalyse. Proteinurie.
Analyse der Zusammensetzung der Aszitesflüssigkeit
Hoher Proteingehalt (mehr als 42 g/l) und Albumin (mehr als 23 g/l), niedrige Anzahl weißer Blutkörperchen, relativ hohe Anzahl roter Blutkörperchen, hohe Konzentrationen aller entzündungsfördernden Zytokine, C-reaktives Protein bis zu 135 mg/l (normal 0–8,2 mg/l), Globulinfraktion von Proteinen.
 [ 25 ], [ 26 ], [ 27 ], [ 28 ], [ 29 ], [ 30 ], [ 31 ]
[ 25 ], [ 26 ], [ 27 ], [ 28 ], [ 29 ], [ 30 ], [ 31 ]
Tumormarker im Blutplasma
Die Konzentration von CA-125, die eine massive Proliferation des Eierstockgewebes widerspiegelt, erreicht ihre Höchstwerte (bis zu 5125 U/ml) in der zweiten Woche der OHSS-Entwicklung, wenn beide Eierstöcke am stärksten vergrößert sind. Der erhöhte Spiegel des Tumormarkers bleibt trotz der Behandlung bis zu 15–23 Wochen nach Auftreten der Anzeichen eines ovariellen Überstimulationssyndroms bestehen.
Bei 50 % der Patienten wird Procalcitonin im Blutserum im Bereich von 0,5–2,0 ng/ml bestimmt, was als mäßige systemische Entzündungsreaktion gilt.
Mikrobiologische Forschung
Bei der Untersuchung des aus der Vagina und dem Zervikalkanal abgesonderten Urins werden atypische Krankheitserreger wie Pseudomonas, Proteus, Klebsiella, Enterobacter und E. coli in Mengen von über 10.000 KBE/ml isoliert.
Instrumentelle Forschung
Ultraschall der Beckenorgane
Vergrößerte Eierstöcke mit einem Durchmesser von 6 bis 25 cm und mehreren Zysten, normal große oder vergrößerte Gebärmutter, Vorhandensein von freier Flüssigkeit in der Beckenhöhle und normale fortschreitende Einlings- oder Mehrlingsschwangerschaft.
Ultraschall der Bauchorgane
Das Vorhandensein von freier Flüssigkeit in der Bauchhöhle in einer Menge von 1 bis 5-6 Litern. Normale Größe und Struktur der Leber oder Hepatomegalie. Echozeichen einer Gallendyskinesie. Bei der Untersuchung der Nieren ist der Kelch-Becken-Komplex unverändert.
Ultraschall der Pleurahöhlen
Vorhandensein von freier Flüssigkeit EchoCG. Vor dem Hintergrund hämodynamischer Störungen, verminderter EF, vermindertem enddiastolischen Volumen, vermindertem venösen Rückfluss, in einigen Fällen - Vorhandensein von freier Flüssigkeit in der Perikardhöhle.
EKG
Rhythmusstörungen wie ventrikuläre Extrasystole, Tachykardie, diffuse Stoffwechsel- und Elektrolytveränderungen im Myokard. Röntgen-Thorax. Wird bei Verdacht auf ARDS und Thromboembolie durchgeführt. Ein charakteristischer Röntgenbefund bei ARDS ist das Auftreten eines Milchglasmusters und diffuser multifokaler Infiltrate relativ hoher Dichte (Konsolidierung) mit gut definierten Luftbronchien, d. h. die Entwicklung ausgedehnter Lungenparenchymschäden. Bei einer Lungenembolie zeigt das Röntgenbild eine hohe Position der Zwerchfellkuppel, diskoide Atelektase, eine Plethora einer der Lungenwurzeln oder eine „abgeschnittene“ Wurzel, eine Erschöpfung des Lungenmusters über dem ischämischen Lungenbereich und einen peripheren dreieckigen Entzündungsschatten.
Indikationen für die Konsultation anderer Spezialisten
Aufgrund der Beteiligung aller Organe und Systeme am Krankheitsgeschehen ist eine Untersuchung durch einen Therapeuten zwingend erforderlich. Bei Verdacht auf thrombotische Komplikationen ist eine Konsultation mit einem Gefäßchirurgen erforderlich. Bei ausgeprägtem Hydrothorax ist eine Konsultation mit einem Thoraxchirurgen erforderlich, um über die Durchführung einer Pleurapunktion zu entscheiden.
Was muss untersucht werden?
Welche Tests werden benötigt?
Behandlung des ovariellen Überstimulationssyndroms
Das Fehlen eines klaren Konzepts zur Pathophysiologie des OHSS macht es unmöglich, eine wirksame, pathogenetisch fundierte Behandlung durchzuführen, die es ermöglicht, die Entwicklung des Syndroms und der multiplen Organerkrankungen, die mit schweren Formen des ovariellen Überstimulationssyndroms einhergehen, effektiv und rasch zu stoppen. Derzeit gibt es keine spezifische Therapie für das ovarielle Überstimulationssyndrom, deshalb beschränken sich die Behandlungsmaßnahmen für diese Patientinnen auf die pathogenetische Therapie bis zur spontanen Rückbildung des Syndroms, da die hCG-Konzentration im Blutplasma innerhalb von 7 Tagen in Zyklen ohne Schwangerschaft bzw. 10-20 Tagen bei eingetretener Schwangerschaft abnimmt. Die meisten Patientinnen auf Intensivstationen werden bereits nach einer ambulanten Behandlung mit der Diagnose OHSS eingeliefert. Die Behandlung besteht aus täglichen Kontrollen von Gewicht und Diurese, Einschränkung übermäßiger körperlicher und sexueller Aktivität, reichlichem Trinken unter Zugabe von elektrolytreichen Lösungen und regelmäßigen Blutuntersuchungen. Die Diskussion der Behandlungsstrategie für diese Patientengruppe umfasst eine umfassende symptomatische Behandlung mit dem Ziel, die Entwicklung von PRF durch Wiederherstellung des CCP, Beseitigung der Hämokonzentration, Elektrolytstörungen, Vorbeugung von akutem Nierenversagen, ARDS und thromboembolischen Komplikationen zu verhindern.
Stufe 1 - Beurteilung des Schweregrads der Erkrankung
Der erste Schritt zur Festlegung der Behandlungstaktik bei Patientinnen mit ovariellem Überstimulationssyndrom ist die Beurteilung der Hämodynamik und der Atemfunktion. Darüber hinaus ist eine vollständige körperliche Untersuchung mit einer gründlichen Untersuchung des Zustands der Gliedmaßen, des Kopf- und Halsbereichs erforderlich, um eine tiefe Venenthrombose auszuschließen und einen peripheren Venenkatheter oder eine zentrale Venenkatheterisierung zu legen. Am besten geeignet ist eine Katheterisierung der Vena subclavia, da hier das Thromboserisiko am geringsten ist. Eine Blasenkatheterisierung ist zur Beurteilung der Diurese erforderlich. Tägliche Kontrollen der klinischen Blutwerte, der Elektrolyte im Blutplasma, des Proteins, der Leberenzymaktivität, des Kreatinins, des Harnstoffspiegels und des Koagulogramms sind erforderlich. Eine Ultraschalluntersuchung des Abdomens wird durchgeführt, um den Grad der Ovarialvergrößerung und das Vorhandensein von Aszites festzustellen.
Stufe 2 – Infusionstherapie
Die medikamentöse Therapie von Patientinnen mit OHSS sollte auf die Aufrechterhaltung der Hämodynamik und die Mobilisierung der im Bauchraum enthaltenen Flüssigkeit durch die Schaffung einer negativen Natrium- und Wasserbilanz abzielen. Das primäre Ziel ist der Ersatz des zirkulierenden Flüssigkeitsvolumens, um die Hämokonzentration zu reduzieren und eine ausreichende Nierenfiltration aufrechtzuerhalten. Kristalloide und kolloidale Lösungen werden zur Infusionstherapie des ovariellen Überstimulationssyndroms eingesetzt.
Die Wahl der kristalloiden Lösung richtet sich nach dem Elektrolytungleichgewicht. Bei der Bestimmung der verabreichten Kristalloidmenge ist zu berücksichtigen, dass bei generalisierter Endothelschädigung das Volumen dieser Lösungen 2-3 mal geringer sein sollte als das Volumen kolloidaler Lösungen, da das Überwiegen von Kristalloiden die Flüssigkeitsansammlung in serösen Hohlräumen verstärkt und in manchen Fällen zur Entwicklung einer Anasarka führt.
Das Medikament der Wahl zur Wiederherstellung und Aufrechterhaltung des intravaskulären Volumens bei Patienten mit OHSS ist Hydroxyethylstärke 130/0 42 Tagesvolumen - 25-30 ml/kg. Hydroxyethylstärke 200/0 5 kann auch in der Basistherapie von OHSS in einem Volumen von 20 ml/(kg x Tag) verwendet werden. Es kann sich jedoch im Körper anreichern und bei längerer Anwendung zu Leberfunktionsstörungen und einem Anstieg der Lebertransaminasen führen, manchmal auf bis zu 800 U/l. Bei diesem Patientenkontingent ist die Verwendung von Hydroxyethylstärke 450/0 7 aufgrund des hohen Risikos allergischer Reaktionen, negativer Auswirkungen auf die Nieren- und Leberfunktion, Verschlechterung der Hämokoagulationsparameter (Verlängerung der Blutgerinnungszeit, Risiko hämorrhagischer Komplikationen) nicht geeignet. Die Indikationen für die Anwendung von Dextranlösungen sind begrenzt durch die hohe Häufigkeit allergischer Reaktionen, negative Auswirkungen auf das Hämostasesystem, die Freisetzung des von-Willebrand-Faktors, die Induktion der proinflammatorischen Kaskade und den fehlenden Einfluss auf die rheologischen Eigenschaften des Blutes in den verwendeten Dosen. Die Infusion von Dextrane unter Bedingungen erhöhter Kapillarpermeabilität kann zur Entwicklung des sogenannten Dextran-Syndroms führen, begleitet von OL, eingeschränkter Leber- und Nierenfunktion sowie der Entwicklung einer Koagulopathie. Gelatinelösungen sind auch nicht für die Infusionstherapie bei OHSS vorgesehen.
Bei einer Hypoproteinämie unter 25 g/l wird eine 20%ige Albuminlösung verwendet, das Tagesvolumen beträgt 3 ml/kg. Es wird empfohlen, nur eine 20%ige Albuminlösung zu verwenden, da der onkotische Druck einer 20%igen Lösung etwa 100 mmHg und der onkotische Druck einer 5%igen Lösung etwa 20 mmHg beträgt. Unter Bedingungen hoher Permeabilität des Gefäßendothels führt die Infusion einer 5%igen Albuminlösung im Gegensatz zu einer 20%igen Lösung zu einem intensiveren Austausch mit dem extravaskulären Pool und einem starken Anstieg des onkotischen Drucks im Interstitium, was zu einer Zunahme der interstitiellen Hyperhydratation der Lunge führt.
Diuretika sind bei Oligurie, peripheren Ödemen und Hämatokritwerten von 36–38 % gerechtfertigt. Eine vorzeitige oder übermäßige Diuretika-Verschreibung kann eine Verschlimmerung der Hypovolämie und Hämokonzentration hervorrufen und das Risiko thrombotischer Komplikationen erhöhen. Hauptsächlich wird Furosemid angewendet – 20–40 mg einmalig intramuskulär oder intravenös langsam über 1–2 Minuten.
Prinzipien der Infusionstherapie beim ovariellen Überstimulationssyndrom
Nach Verabreichung der Anfangsdosis der kristalloiden und kolloidalen Lösungen wird das Volumen der weiteren Infusionstherapie unter Berücksichtigung der folgenden Parameter bestimmt: Diurese – weniger als 1 ml/(kg h), Hämatokrit weniger als – 40 %, mittlerer arterieller Blutdruck – mehr als 70 mmHg, zentralvenöser Druck – 8–10 mmH2O. Wenn die angegebenen Parameter erreicht sind, wird die Infusionstherapie beendet. Es wird empfohlen, das gesamte Tagesvolumen der Infusionslösungen in Fraktionen über den Tag verteilt zu verabreichen. Die Missachtung dieser Vorgehensweisen führt zur Entwicklung einer Hämodilution, die eine schnelle Ansammlung von Flüssigkeit in den serösen Hohlräumen und eine Verschlechterung des Zustands der Patientin verursacht. Ein typischer Fehler bei der Behandlung von Frauen mit OHSS ist die ungerechtfertigte Verlängerung der Infusionstherapie, wenn sich die hämodynamischen Parameter normalisiert haben, und der Versuch, die Entwicklung von OHSS als iatrogener Erkrankung vollständig zu stoppen.
Stufe 3 - Vorbeugung von Komplikationen
Prävention von Thrombosen und Thromboembolien
Grundlage für die Vorbeugung thrombotischer Komplikationen beim ovariellen Überstimulationssyndrom ist die Eliminierung der Hämokonzentration. Eine antithrombotische Therapie ist angezeigt, wenn Laborsymptome einer Hyperkoagulation auftreten. NMH wird hierfür eingesetzt:
- Calcium-Nadroparin (Tagesdosis – 100 Anti-Xa IE/kg 2-mal subkutan),
- Dalteparin-Natrium (100-150 Anti-Xa IE/kg 2-mal subkutan),
- Enoxaparin-Natrium (1 ml/kg/Tag) 1-2-mal subkutan).
Laborüberwachung – Bestimmung der Plasma-Anti-Xa-Aktivität 3 Stunden nach NMH-Gabe. Dies ermöglicht die Aufrechterhaltung einer wirksamen Dosis des Arzneimittels im sicheren therapeutischen Bereich und minimiert so das Blutungsrisiko. Antithrombotische Medikamente werden weiter eingenommen, bis sich die Blutgerinnungsparameter normalisiert haben. Die Überwachung erfolgt durch quantitative Bestimmung der D-Dimer-Konzentration im Plasma. Die Dauer der NMH-Gabe wird individuell festgelegt und kann in einigen Fällen 30 Tage überschreiten.
Prävention von infektiösen Komplikationen
Angesichts des positiven Effekts der Verschreibung von Immunglobulinpräparaten zur Vorbeugung von Sekundärinfektionen bei anderen Erkrankungen mit Proteinverlust ist mit einer Wirksamkeit dieser Therapie bei Patienten mit OHSS zu rechnen. Zur endgültigen Bestätigung oder Widerlegung dieser Hypothese aus Sicht der evidenzbasierten Medizin sind jedoch weitere Studien erforderlich. Die Indikation für eine empirische Antibiotikatherapie ist derzeit das Risiko einer Sekundärinfektion bei Patienten in kritischem Zustand oder mit instabiler Hämodynamik. Das empirisch ausgewählte Medikament wird basierend auf den Ergebnissen bakteriologischer Tests geändert. Bei der Verschreibung einer empirischen Antibiotikatherapie müssen Informationen über den Schweregrad der Erkrankung, Infektionsrisikofaktoren und die Merkmale der Antibiotikaresistenz auf der jeweiligen Intensivstation berücksichtigt werden.
Ernährungsunterstützung
Es wird allen Patienten mit schwerem und kritischem OHSS oral verabreicht. Es ist notwendig, die Empfehlungen zu befolgen:
- Energiewert 25-35 kcal/(kgxTag),
- Glukose - weniger als 6 g/(kg x Tag),
- Lipide - 0,5-1 g/(kg x Tag),
- Proteine - 1,2-2 g/(kg x Tag),
- Standard-Tagesdosis an Mikroelementen und Vitaminen.
Stufe 4 - chirurgische Methoden
Indikationen zur Laparozentese bei Frauen mit ovariellem Überstimulationssyndrom:
- progressiver angespannter Aszites,
- Oligurie weniger als 0,5 ml/dkg/min),
- ein Anstieg der Kreatininkonzentration über 80 μmol/l oder eine Verringerung der Kreatinin-Clearance,
- Hämokonzentration mit einem Hämatokritwert von über 40 %, der einer medikamentösen Korrektur nicht zugänglich ist.
Für die Laparozentese kann ein transabdominaler oder transvaginaler Zugang gewählt werden. Vergrößerte Eierstöcke verursachen technische Schwierigkeiten, weshalb die Ultraschallkontrolle äußerst wichtig ist. Eine Langzeitdrainage der Bauchhöhle (transabdominale Laparozentese) von 14 bis 30 Tagen mit portionierter Entnahme des Peritonealtranssudats mittels pyrogenfreiem CystoFix®-Katheter bietet zahlreiche Vorteile. So wird die einmalige Entnahme großer Mengen Peritonealtranssudat vermieden und dadurch starke Schwankungen des intraabdominalen Drucks, die hämodynamische Störungen verursachen, eliminiert, der Zustand der Patientin stabilisiert und wiederholte Punktionen der Bauchhöhle zur Entnahme von Aszitesflüssigkeit bei dieser Patientengruppe vermieden. Das Gesamtvolumen der entnommenen Aszitesflüssigkeit während der Behandlung eines schweren OHSS kann zwischen 30 und 90 Litern liegen.
Bei Patienten mit Hydrothorax vor dem Hintergrund eines ovariellen Überstimulationssyndroms ist ein abwartendes Vorgehen gerechtfertigt. Bei der Bildung eines Hydrothorax wird eine Punktion der Pleurahöhle nur bei schwerer progressiver Ateminsuffizienz durchgeführt.
Kriterien für den Beginn einer Atemunterstützung bei schwerem und kritischem ovariellen Überstimulationssyndrom:
- fehlende Spontanatmung und pathologische Atemrhythmen,
- Abnahme des Atemindex auf unter 200 mmHg,
- lebensbedrohliche Herzrhythmusstörungen,
- anhaltende Tachykardie über 120,
- schwere Hypotonie,
- Tachypnoe über 40,
- Beteiligung der Atemhilfsmuskulatur.
Bei der Entwicklung eines ARDS und der Umstellung auf mechanische Beatmung kommt folgendes zum Einsatz:
- kleine Atemvolumina (6 ml/kg),
- Inspirationsdruck <30 cm H2O,
- PEEP (>10 cm H2O),
- Es wird das Alveolarrekrutierungsmanöver verwendet.
Die chirurgische Behandlung des ovariellen Überstimulationssyndroms ist nur bei akuter Pathologie der Torsion des Anus, Ruptur der Ovarialzyste oder Blutung aus der Ovarialzyste gerechtfertigt. Bei einer Ovarialtorsion ist die laparoskopische Ovarialaufdrehung am effektivsten. Ein typischer Fehler in der Behandlungsstrategie bei Patientinnen mit unkompliziertem OHSS ist eine Notoperation und Resektion von etwa 30-50% des Ovarialgewebes oder eine beidseitige Ovarektomie.

