
Alle iLive-Inhalte werden medizinisch überprüft oder auf ihre Richtigkeit überprüft.
Wir haben strenge Beschaffungsrichtlinien und verlinken nur zu seriösen Medienseiten, akademischen Forschungseinrichtungen und, wenn möglich, medizinisch begutachteten Studien. Beachten Sie, dass die Zahlen in Klammern ([1], [2] usw.) anklickbare Links zu diesen Studien sind.
Wenn Sie der Meinung sind, dass einer unserer Inhalte ungenau, veraltet oder auf andere Weise bedenklich ist, wählen Sie ihn aus und drücken Sie Strg + Eingabe.
Künstliche Intelligenz könnte Behandlungen zur Verhinderung von "Superbakterien" entwickeln
Zuletzt überprüft: 02.07.2025
 ">
">Forscher der Cleveland Clinic haben ein KI-Modell entwickelt, das die optimale Kombination und den optimalen Zeitpunkt von Medikamenten zur Behandlung einer bakteriellen Infektion allein anhand der Wachstumsrate der Bakterien unter bestimmten Bedingungen bestimmen kann. Das Team unter der Leitung von Dr. Jacob Scott und seinem Labor in der Theoretischen Abteilung für Translationale Hämatologie und Onkologie veröffentlichte seine Ergebnisse kürzlich in der Fachzeitschrift Proceedings of the National Academy of Sciences.
Antibiotika haben die durchschnittliche Lebenserwartung in den USA um fast ein Jahrzehnt erhöht. Die Behandlungen reduzierten die Sterberate bei heute als geringfügig geltenden Gesundheitsproblemen wie Schnittwunden und Verletzungen. Antibiotika wirken jedoch nicht mehr so gut wie früher, was unter anderem an ihrer weiten Verbreitung liegt.
„Globale Gesundheitsorganisationen sind sich einig, dass wir in ein postantibiotisches Zeitalter eintreten“, erklärt Dr. Scott. „Wenn wir unsere Bekämpfung von Bakterien nicht ändern, werden bis 2050 mehr Menschen an antibiotikaresistenten Infektionen sterben als an Krebs.“
Bakterien vermehren sich schnell und produzieren mutierte Nachkommen. Übermäßiger Einsatz von Antibiotika gibt Bakterien die Möglichkeit, Mutationen zu entwickeln, die gegen die Behandlung resistent sind. Mit der Zeit töten Antibiotika alle anfälligen Bakterien ab, sodass nur die stärkeren Mutanten übrig bleiben, die Antibiotika nicht abtöten können.
Eine Strategie, die Ärzte zur Optimierung der Behandlung bakterieller Infektionen einsetzen, ist die sogenannte Antibiotikarotation. Dabei wechseln medizinisches Personal im Laufe der Zeit zwischen verschiedenen Antibiotika. Durch den Wechsel zwischen verschiedenen Medikamenten haben Bakterien weniger Zeit, Resistenzen gegen eine bestimmte Antibiotikaklasse zu entwickeln. Die Rotation kann Bakterien sogar anfälliger für andere Antibiotika machen.
„Die Medikamentenrotation ist vielversprechend für die wirksame Behandlung von Krankheiten“, sagt Dr. Davis Weaver, Erstautor der Studie und Medizinstudent. „Das Problem ist, dass wir nicht wissen, wie man am besten vorgeht. Es gibt keine Standards dafür, welches Antibiotikum verabreicht werden soll, wie lange oder in welcher Reihenfolge.“
Der Co-Autor der Studie, Dr. Jeff Maltas, Postdoktorand an der Cleveland Clinic, nutzt Computermodelle, um vorherzusagen, wie Bakterien durch ihre Resistenz gegen ein Antibiotikum gegenüber einem anderen geschwächt werden. Gemeinsam mit Dr. Weaver untersuchte er, ob datenbasierte Modelle Medikamentenrotationsmuster vorhersagen können, die trotz der zufälligen Natur der bakteriellen Evolution die Antibiotikaresistenz minimieren und die Anfälligkeit maximieren.
Dr. Weaver leitete die Anwendung von Reinforcement Learning auf das Medikamentenrotationsmodell. Dieses Modell lehrt einen Computer, aus seinen Fehlern und Erfolgen zu lernen und so die beste Strategie zur Erledigung einer Aufgabe zu bestimmen. Laut Dr. Weaver und Dr. Maltas ist die Studie eine der ersten, die Reinforcement Learning auf Antibiotika-Rotationsschemata anwendet.
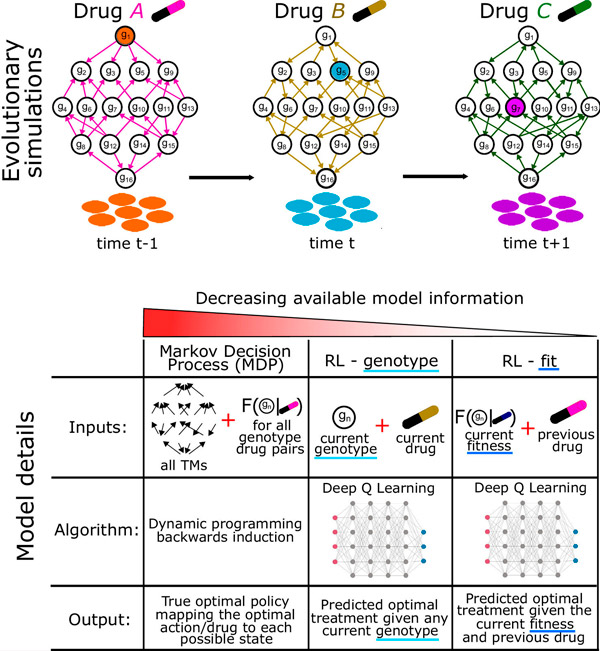
Schematische evolutionäre Simulation und getestete Optimierungsansätze. Quelle: Proceedings of the National Academy of Sciences (2024). DOI: 10.1073/pnas.2303165121
„Verstärkendes Lernen ist ein idealer Ansatz, da man nur wissen muss, wie schnell die Bakterien wachsen, was relativ einfach zu bestimmen ist“, erklärt Dr. Weaver. „Außerdem besteht Raum für menschliche Abweichungen und Fehler. Man muss die Wachstumsrate nicht jedes Mal auf die Millisekunde genau messen.“
Die KI des Forschungsteams konnte die effektivsten Antibiotika-Rotationspläne zur Behandlung mehrerer E. coli-Stämme und zur Vorbeugung von Arzneimittelresistenzen ermitteln. Die Studie zeigt, dass KI komplexe Entscheidungen, wie beispielsweise die Berechnung von Antibiotika-Behandlungsplänen, unterstützen kann, sagt Dr. Maltas.
Dr. Weaver erklärt, dass das KI-Modell des Teams nicht nur die Behandlung von Infektionen bei einzelnen Patienten, sondern auch die allgemeine Behandlung von Infektionen in Krankenhäusern beeinflussen könnte. Er und sein Forschungsteam arbeiten zudem daran, ihre Arbeit über bakterielle Infektionen hinaus auf andere tödliche Krankheiten auszuweiten.
„Diese Idee ist nicht auf Bakterien beschränkt, sondern lässt sich auf jedes Objekt anwenden, das Resistenzen gegen Behandlungen entwickeln kann“, sagt er. „Wir glauben, dass diese Art der KI in Zukunft zur Behandlung therapieresistenter Krebsarten eingesetzt werden könnte.“
