
Alle iLive-Inhalte werden medizinisch überprüft oder auf ihre Richtigkeit überprüft.
Wir haben strenge Beschaffungsrichtlinien und verlinken nur zu seriösen Medienseiten, akademischen Forschungseinrichtungen und, wenn möglich, medizinisch begutachteten Studien. Beachten Sie, dass die Zahlen in Klammern ([1], [2] usw.) anklickbare Links zu diesen Studien sind.
Wenn Sie der Meinung sind, dass einer unserer Inhalte ungenau, veraltet oder auf andere Weise bedenklich ist, wählen Sie ihn aus und drücken Sie Strg + Eingabe.
Neue Studie zeigt Schlüsselrolle mitochondrialer Proteine bei der Herzregeneration
Zuletzt überprüft: 02.07.2025
 ">
">Mitochondrien spielen eine entscheidende Rolle bei der Bereitstellung der für eine reibungslose Zellfunktion benötigten Energie. In Mitochondrien wird Energie durch die Atmungskette erzeugt, die aus fünf Komplexen, den sogenannten CI-CV-Komplexen, besteht. Diese Komplexe können sich zu Superkomplexen zusammenlagern, doch über die Rolle dieses Prozesses und seine Steuerung ist wenig bekannt.
Die neue Studie untersucht die Mechanismen der Superkomplex-Assemblierung und zeigt einen signifikanten Einfluss mitochondrialer Assemblierungsfaktoren auf die Regeneration von Herzgewebe. Die Studie wurde gemeinsam von Dr. José Antonio Enríquez vom Nationalen Zentrum für Herz-Kreislauf-Forschung (CNIC) und Dr. Nadia Mercader von der Universität Bern, Schweiz, geleitet, die Gastwissenschaftlerin am CNIC ist.
Eine im Fachjournal Developmental Cell veröffentlichte Studie zeigt, dass das Protein Cox7a eine grundlegende Rolle bei der Zusammensetzung von CIV-Dimeren spielt und dass diese Zusammensetzung für die ordnungsgemäße Funktion der Mitochondrien und damit für die zelluläre Energieproduktion von entscheidender Bedeutung ist.
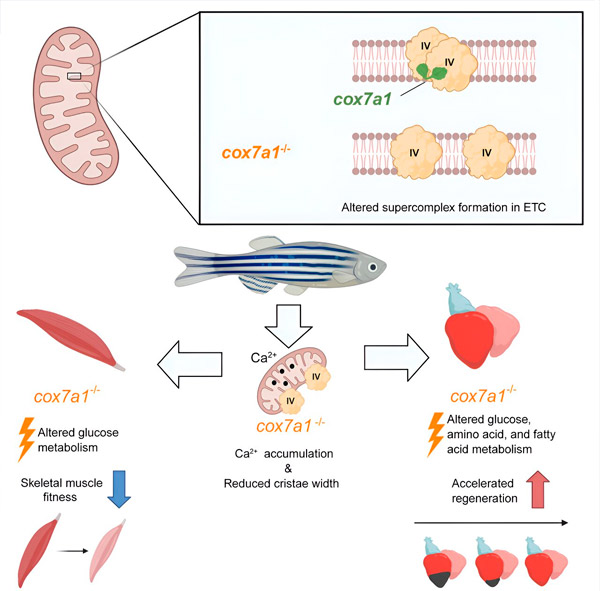
Die Cox7a-Proteinfamilie umfasst drei Mitglieder: Cox7a1, Cox7a2 und Cox7a2l (auch SCAF1 genannt). Frühere Studien beider Gruppen haben gezeigt, dass CIV, wenn es SCAF1 enthält, stark mit CIII assoziiert und einen respiratorischen Superkomplex, das sogenannte Respirasom, bildet. In diesen früheren Studien stellten die Autoren die Hypothese auf, dass die Einbeziehung von Cox7a2 zu CIV führen würde, das nicht assoziieren kann, während CIV-Moleküle, die Cox7a1 enthalten, zu CIV-Homodimeren assoziieren würden. Die neue Studie zeigt experimentell, dass Cox7a1 bei der Bildung dieser CIV-Homodimere eine Rolle spielt.
Entwicklungszelle (2024). DOI: 10.1016/j.devcel.2024.04.012
Bei ihrer Arbeit mit einem Zebrafischmodell stellten die Forscher fest, dass das Fehlen von Cox7a1 die Bildung von CIV-Dimeren verhinderte und der Verlust dieser Dimere das Gewicht und die Schwimmfähigkeit der betroffenen Fische beeinträchtigte.
„Cox7a1 wird vor allem in quergestreiften Muskelzellen exprimiert, und es war das Skelettmuskelgewebe, das am stärksten unter dem Mangel an Cox7a1-Funktion litt. Der andere wichtige Typ quergestreifter Muskeln ist der Herzmuskel, auch Myokard genannt“, erklärte Dr. Enriquez.
Während der Verlust von Cox7a1 im Skelettmuskel schädlich war, verbesserte sein Fehlen im Herzmuskel die regenerative Reaktion des Herzens auf Verletzungen.
„Dieses Ergebnis zeigt, dass diese Proteine eine Schlüsselrolle bei der Aktivierung der Selbstheilungsfähigkeit des Herzens nach einer Verletzung spielen“, erklärt die Erstautorin der Studie, Carolina Garcia-Pojatos.
Um die Funktion von Cox7a1 weiter zu erforschen, führten die CNIC-Forscher Enrique Calvo und Jesús Vásquez eine proteomische Studie der Skelettmuskulatur und des Myokards bei Zebrafischen ohne Cox7a1 durch. Diese Analyse wurde durch eine Metabolomik-Studie von Kollegen der Universität Bern ergänzt. Diese kombinierte Analyse zeigte signifikante Unterschiede zu unveränderten Fischen mit intakter Cox7a1-Expression.
„Diese Ergebnisse legen nahe, dass Moleküle, die an der Bildung mitochondrialer Superkomplexe beteiligt sind, erhebliche Auswirkungen auf die Stoffwechselkontrolle haben könnten und damit möglicherweise den Weg für neue Behandlungsmethoden für Herzkrankheiten und andere Stoffwechselerkrankungen ebnen“, sagte Dr. Mercader.
Laut dem Forschungsteam stellt diese Entdeckung „einen bedeutenden Fortschritt im Verständnis der zellulären Mechanismen dar, die an der Herzregeneration beteiligt sind, und könnte den Weg für die Entwicklung von Therapien zur Stimulierung der Herzregeneration weisen.“
Die Autoren kommen zu dem Schluss, dass mitochondriale Assemblierungsfaktoren die Stoffwechselkontrolle erheblich beeinflussen können.
