
Alle iLive-Inhalte werden medizinisch überprüft oder auf ihre Richtigkeit überprüft.
Wir haben strenge Beschaffungsrichtlinien und verlinken nur zu seriösen Medienseiten, akademischen Forschungseinrichtungen und, wenn möglich, medizinisch begutachteten Studien. Beachten Sie, dass die Zahlen in Klammern ([1], [2] usw.) anklickbare Links zu diesen Studien sind.
Wenn Sie der Meinung sind, dass einer unserer Inhalte ungenau, veraltet oder auf andere Weise bedenklich ist, wählen Sie ihn aus und drücken Sie Strg + Eingabe.
Humanes Immundefizienz-Virus (HIV)
Facharzt des Artikels
Zuletzt überprüft: 04.07.2025
Das erworbene Immunschwächesyndrom wurde 1981 in den USA als spezifische Krankheit identifiziert, als eine Reihe junger Menschen schwere Erkrankungen entwickelten, die durch Mikroorganismen verursacht wurden, die für gesunde Menschen nicht oder nur schwach pathogen waren. Eine Untersuchung des Immunstatus der Patienten ergab einen starken Rückgang der Lymphozytenzahl im Allgemeinen und der T-Helferzellen im Besonderen. Dieser Zustand wurde als AIDS (Acquired Immune Deficiency Syndrome) bezeichnet. Der Infektionsweg (sexueller Kontakt, durch Blut und Blutpräparate) wies auf die infektiöse Natur der Krankheit hin.
Der Erreger von AIDS wurde 1983 unabhängig voneinander von dem Franzosen L. Montagnier entdeckt, der ihn LAV Lymphoadenopathy Associated Virus nannte, da er ihn bei einem Patienten mit Lymphadenopathie fand, und dem Amerikaner R. Gallo, der das Virus HTLV-III (Human T-lymphotropes Virus III) nannte: Er hatte zuvor die lymphotropen Viren I und II entdeckt.
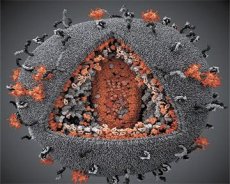
Ein Vergleich der Eigenschaften der Viren LAV und HTLV-III ergab ihre Identität. Um Verwechslungen zu vermeiden, wurde das Virus 1986 HIV (Humanes Immundefizienz-Virus, kurz HIV) genannt. HIV hat eine kugelförmige Gestalt mit einem Durchmesser von 110 nm. Die Virushülle hat die Form eines Polyeders, das aus 12 Fünfecken und 20 Sechsecken besteht. Im Zentrum und in den Ecken jedes Sechsecks befindet sich ein Molekül des glykosylierten Proteins gpl20 (die Zahl 120 gibt das Molekulargewicht des Proteins in Kilodalton an). Auf der Oberfläche des Virions befinden sich insgesamt 72 gpl20-Moleküle in Form eigenartiger Spikes, von denen jeder mit dem intramembranären Protein gp41 assoziiert ist. Diese Proteine bilden zusammen mit der doppelten Lipidschicht das Superkapsid (die Membran) des Virions.
Die Proteine gpl20 und gp41 entstehen durch das Schneiden des Env-Vorläuferproteins durch eine zelluläre Protease. Das gp41-Protein bildet den Spike-„Stamm“, indem es mit seiner zytoplasmatischen Domäne an das Matrixprotein p17MA bindet, das sich direkt unter der Hülle befindet. Die p17-Moleküle interagieren während der Virionenreifung und bilden ein Ikosaeder, das der Hülle zugrunde liegt.
Im zentralen Teil des Virions bildet das Protein p24 ein kegelförmiges Kapsid. Der verengte Teil des Kapsids ist über das Protein rb mit der Virionmembran verbunden. Im Kapsid befinden sich zwei identische Moleküle viraler genomischer RNA. Sie sind über ihre 5'-Enden mit dem Nukleokapsidprotein p7NC verbunden. Dieses Protein ist interessant, da es zwei cystein- und histidinreiche Aminosäurereste (Motive) mit einem Zinkatom aufweist – sie werden „Zinkfinger“ genannt, da sie genomische RNA-Moleküle für den Einbau in die entstehenden Virionen einfangen. Das Kapsid enthält außerdem drei Enzyme. Die Revertase (RT) oder der Pol-Komplex umfasst reverse Transkriptase, RNase H und DNA-abhängige DNA-Polymerase. Revertase liegt als Heterodimer p66/p51 vor. Die Protease (PR) p10 initiiert und implementiert den Prozess der Virionenreifung. Integrase (IN) - p31 oder Endonuklease sorgt für den Einbau proviraler DNA in das Genom der Wirtszelle. Das Kapsid enthält außerdem ein Molekül Primer-RNA (tRNA13).
Das RNA-Genom in der Zelle wird mithilfe der reversen Transkriptase in ein DNA-Genom (DNA-Provirus) umgewandelt, das aus 9283 Nukleotidpaaren besteht. Es wird links und rechts von sogenannten Long Terminal Repeats (LTRs) begrenzt: links S'-LTR und rechts 3'-LTR. Jeder LTR enthält 638 Nukleotidpaare.
Das HIV-Genom besteht aus neun Genen, die sich teilweise an den Enden überlappen (mehrere Leserahmen haben) und eine Exonintron-Struktur besitzen. Sie steuern die Synthese von neun Strukturproteinen und sechs regulatorischen Proteinen.
Die Bedeutung der LTRs für das virale Genom liegt darin, dass sie die folgenden regulatorischen Elemente enthalten, die dessen Funktion steuern:
- Transkriptionssignal (Promotorregion);
- Poly-A-Additionssignal;
- Begrenzungssignal;
- Integrationssignal;
- positives Regulationssignal (TAR für TAT-Protein);
- negatives regulatorisches Element (NRE für NEF-Protein);
- eine Stelle zur Anheftung von Primer-RNA (tRNA™3) für die Synthese des Minusstrangs der DNA am 3'-Ende; ein Signal am 5'-Ende des LTR, das als Primer für die Synthese des Plusstrangs der DNA dient.
Darüber hinaus enthält LTR Elemente, die an der Regulierung des mRNA-Spleißens und der Verpackung von vRNA-Molekülen in das Kapsid beteiligt sind (Psi-Element). Schließlich werden während der Genomtranskription in langen mRNAs zwei Signale für das REV-Protein gebildet, die die Proteinsynthese umschalten: CAR – für regulatorische Proteine und CRS – für Strukturproteine. Bindet das REV-Protein an CAR, werden Strukturproteine synthetisiert; fehlt es, werden nur regulatorische Proteine synthetisiert.
Die folgenden regulatorischen Gene und ihre Proteine spielen eine besonders wichtige Rolle bei der Regulierung der Funktion des Virusgenoms:
- TAT-Protein, das eine positive Kontrolle der Virusreplikation durchführt und über die TAR-Regulationsregion wirkt;
- NEV- und VPU-Proteine, die über die NRE-Region eine negative Kontrolle der Replikation ausüben;
- REV-Protein, das die Positiv-Negativ-Kontrolle durchführt. Das REV-Protein steuert die Arbeit der Gene gag, pol und env und führt die negative Regulierung des Spleißens durch.
Somit unterliegt die HIV-Replikation einer dreifachen Kontrolle: positiv, negativ und positiv-negativ.
Das VIF-Protein bestimmt die Infektiosität des neu synthetisierten Virus. Es ist mit dem Kapsidprotein p24 assoziiert und im Virion in einer Menge von 60 Molekülen vorhanden. Das NEF-Protein ist im Virion durch eine kleine Anzahl von Molekülen (5–10) vertreten, die möglicherweise mit der Hülle assoziiert sind.
Das VPR-Protein hemmt den Zellzyklus in der G2-Phase, ist am Transport von Präintegrationskomplexen in den Zellkern beteiligt, aktiviert einige virale und zelluläre Gene und erhöht die Effizienz der Virusreplikation in Monozyten und Makrophagen. Die Position der Proteine VPR, TAT, REV und VPU im Virion ist nicht geklärt.
Zusätzlich zu ihren eigenen Proteinen kann die Virionmembran einige Proteine der Wirtszelle enthalten. VPU- und VPR-Proteine sind an der Regulierung der Virusreproduktion beteiligt.
Antigene Varianten des humanen Immundefizienzvirus (HIV)
Das humane Immundefizienzvirus (HIV) ist sehr variabel. Selbst aus dem Körper ein und desselben Patienten lassen sich Virusstämme mit deutlich unterschiedlichen antigenen Eigenschaften isolieren. Diese Variabilität wird durch die intensive Zerstörung von CD4+-Zellen und eine starke Antikörperreaktion auf die HIV-Infektion begünstigt. Eine neue Form von HIV, HIV-2, die HIV-1 biologisch ähnelt, sich aber immunologisch davon unterscheidet, wurde aus Patienten in Westafrika isoliert. Die Homologie der Primärstruktur der Genome dieser Viren beträgt 42 %. Das DNA-Provirus HIV-2 umfasst 9671 bp, seine LTR 854 bp. HIV-2 wurde später auch in anderen Regionen der Welt isoliert. Es gibt keine Kreuzimmunität zwischen HIV-1 und HIV-2. Es sind zwei große Formen von HIV-1 bekannt: O (Outlier) und M (Major), letzterer wird in zehn Subtypen (AJ) unterteilt. Acht Subtypen (AH) zirkulieren in Russland.
 [ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
[ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
Der Mechanismus der Interaktion von HIV mit der Zelle
Nachdem das Virus in den Körper eingedrungen ist, greift es zunächst Zellen an, die den für es spezifischen CD4-Rezeptor enthalten. Dieser Rezeptor ist in großen Mengen in T-Helferzellen vorhanden, in kleineren Mengen in Makrophagen und Monozyten. T-Helferzellen reagieren besonders empfindlich auf das Virus.
Das humane Immundefizienzvirus (HIV) erkennt CD4-Rezeptoren über sein Protein gpl20. Die HIV-Interaktion mit der Zelle erfolgt nach folgendem Schema: Rezeptor-vermittelte Adsorption -> beschichtetes Vesikel -> beschichtetes Vesikel -> Lysosom. Dabei verschmilzt die Virionmembran mit der Lysosommembran, und das vom Superkapsid befreite Nukleokapsid gelangt ins Zytoplasma. Auf dem Weg zum Zellkern wird es zerstört, und genomische RNA und zugehörige Kernkomponenten werden freigesetzt. Anschließend synthetisiert die reverse Transkriptase den Minusstrang der DNA auf der Virion-RNA, anschließend zerstört RNase H die Virion-RNA, und die virale DNA-Polymerase synthetisiert den Plusstrang der DNA. An den Enden des DNA-Provirus bilden sich 5'-LTR und 3'-LTR. Das DNA-Provirus kann einige Zeit in inaktiver Form im Zellkern verbleiben, wird aber früher oder später mithilfe seiner Integrase in das Chromosom der Zielzelle integriert. Dort bleibt das Provirus inaktiv, bis der jeweilige T-Lymphozyt durch mikrobielle Antigene oder andere immunkompetente Zellen aktiviert wird. Die Aktivierung der zellulären DNA-Transkription wird durch einen speziellen Kernfaktor (NF-kB) reguliert. Dieser ist ein DNA-bindendes Protein und wird während der Aktivierung und Proliferation von T-Lymphozyten und Monozyten in großen Mengen produziert. Dieses Protein bindet an bestimmte Sequenzen zellulärer DNA und ähnliche LTR-Sequenzen des DNA-Provirus und induziert die Transkription sowohl der zellulären DNA als auch des DNA-Provirus. Durch die Induktion der Transkription des DNA-Provirus bewirkt es den Übergang des Virus von einem inaktiven in einen aktiven Zustand und dementsprechend von einer persistenten zu einer produktiven Infektion. Das Provirus kann sehr lange in einem inaktiven Zustand verbleiben. Die Aktivierung des Virus ist ein kritischer Moment in seiner Interaktion mit der Zelle.
Sobald das Virus in die Zelle eindringt, beginnt die HIV-Infektion – der Virusträgerzustand, der zehn Jahre oder länger dauern kann. Sobald das Virus aktiviert wird, beginnt die Krankheit – AIDS. Mithilfe seiner regulatorischen Gene und deren Produkte beginnt sich das Virus aktiv zu vermehren. Das TAT-Protein kann die Virusvermehrungsrate um das 1000-fache erhöhen. Die virale Transkription ist komplex. Sie umfasst die Bildung sowohl der vollständigen als auch der subgenomischen mRNA, das mRNA-Spleißen und anschließend die Synthese von Struktur- und regulatorischen Proteinen.
Die Synthese von Strukturproteinen erfolgt wie folgt. Zunächst wird das Vorläufer-Polyprotein Pr55Gag (ein Protein mit einem Molekulargewicht von 55 kDa) synthetisiert. Es enthält 4 Hauptdomänen: Matrix (MA), Kapsid (CA), Nukleokapsid (NC) und die rb-Domäne, aus der durch Schneiden von Pr55Gag durch die virale Protease (es wird selbst aus einem anderen Vorläuferprotein, Gag-Pol, geschnitten) die Strukturproteine p17, p24, p7 bzw. rb gebildet werden. Die Bildung des Pr55Gag-Polyproteins ist die Hauptvoraussetzung für die Bildung viraler Partikel. Es ist dieses Protein, das das Programm der Virion-Morphogenese bestimmt. Es umfasst nacheinander die Stadien des Transports des Gag-Polyproteins zur Plasmamembran, die Interaktion mit ihr und Protein-Protein-Interaktionen während der Bildung des viralen Partikels und seiner Knospung. Pr55Gag wird auf freien Polyribosomen synthetisiert; Proteinmoleküle werden zur Membran transportiert und dort durch ihre hydrophoben Regionen verankert. Die CA-Domäne spielt die Hauptrolle bei der Bildung der nativen Konformation des Gag-Proteins. Die NC-Domäne gewährleistet (mithilfe ihrer „Zinkfinger“) den Einbau von zwei Molekülen genomischer RNA in das entstehende Viruspartikel. Das Polyproteinmolekül dimerisiert zunächst durch die Interaktion der Matrixdomänen. Anschließend verbinden sich die Dimere durch die Interaktion der CA- und NC-Domänen zu hexameren (aus sechs Einheiten bestehenden) Komplexen. Schließlich verbinden sich die Hexamere an ihren Seitenflächen und bilden unreife kugelförmige Virionen, in denen die genomische Virus-RNA enthalten ist, eingefangen von der NC-Domäne.
Ein weiteres Vorläuferprotein, Prl60Gag-Pol (ein Protein mit einem Molekulargewicht von 160 kDa), wird durch einen ribosomalen Frameshift während der Translation des 3'-Endes des gag-Gens in der Region unmittelbar vor der für das rb-Protein kodierenden Region synthetisiert. Dieses Gag-Pol-Polyprotein enthält eine unvollständige Gag-Proteinsequenz (1–423 Aminosäuren) und Pol-Sequenzen, die die PR-, RT- und IN-Domänen umfassen. Gag-Pol-Polyproteinmoleküle werden ebenfalls auf freien Polyribosomen synthetisiert und zur Plasmamembran transportiert. Das Prl60Gagpol-Polyprotein enthält alle dem Gag-Polyprotein innewohnenden intermolekularen Interaktionsstellen und Membranbindungsstellen. Daher fusionieren die Gag-Pol-Polyproteinmoleküle mit der Membran und werden zusammen mit den Gag-Molekülen in die entstehenden Virionen aufgenommen, was zur Entstehung aktiver Proteasen und zum Beginn der Virionenreifung führt. Die HIV-1-Protease ist nur in Form eines Dimers hochaktiv. Daher ist für ihre Selbstexzision von Prl60Gag-Pol die Dimerisierung dieser Moleküle erforderlich. Die Virionenreifung besteht darin, dass die freigesetzte aktive Protease Prl60Gag-Pol und Gag55 an den von ihr erkannten Stellen schneidet. Die Proteine p17, p24, p7, p6, Revertase und Integrase werden gebildet und binden sich an die Virusstruktur.
Das Env-Protein wird an Ribosomen synthetisiert, die mit den Membranen des endoplasmatischen Retikulums assoziiert sind. Anschließend wird es glykosyliert, von einer zellulären Protease in gp120 und gp41 zerlegt und zur Zelloberfläche transportiert. Dabei durchdringt gp41 die Membran und bindet an die Matrixdomänen des Gag-Proteinmoleküls, das mit der inneren Oberfläche der Membran assoziiert ist. Diese Bindung bleibt im reifen Virion erhalten.
Der Zusammenbau viraler Partikel umfasst somit die Aggregation von Vorläuferproteinen und assoziierten RNA-Molekülen auf der Plasmamembran der Wirtszelle, die Bildung unreifer Virionen und deren Freisetzung durch Knospung von der Zelloberfläche. Während der Knospung umgibt sich das Virion mit einer Zellmembran, in die die Moleküle gp41 und gp120 eingebettet sind. Während der Knospung oder möglicherweise nach der Freisetzung der Virionen findet deren Reifung statt, die mithilfe einer viralen Protease durchgeführt wird und aus dem proteolytischen Schneiden der Vorläuferproteine Pr55Gag und Prl60Gag-Pol in Proteine des reifen Virus und ihrer Assoziation zu bestimmten Strukturkomplexen besteht. Die führende Rolle bei den Prozessen der viralen Morphogenese spielt das Vorläuferpolyprotein Pr55Gag, das das unreife Virion organisiert und zusammensetzt; der Reifungsprozess wird durch eine spezifische virale Protease abgeschlossen.
Ursachen der Immunschwäche
Eine der Hauptursachen für Immunschwäche bei HIV-Infektionen ist das Massensterben von T-Helferzellen. Es entsteht durch folgende Ereignisse: Erstens sterben virusinfizierte T-Helferzellen durch Apoptose. Man geht davon aus, dass bei AIDS-Patienten Virusreplikation, Apoptose und eine Abnahme der T-Helferzellen zusammenhängen. Zweitens erkennen und zerstören T-Killerzellen virusinfizierte oder mit adsorbierten gpl20-Molekülen beladene T-Zellen sowie virusinfizierte und nicht virusinfizierte T-Helferzellen, die Symplasten (Synzytium) aus mehreren Dutzend Zellen bilden (einige von ihnen sterben durch die Virusvermehrung in ihnen ab). Infolge der Zerstörung einer großen Anzahl von T-Helfern nimmt die Expression von Membranrezeptoren in B-Lymphozyten für Interleukin-2 ab, die Synthese verschiedener Interleukine (Wachstumsfaktoren und Differenzierung von B-Lymphozyten - IL-4, IL-5, IL-6 usw.) wird gestört, was zu einer Funktionsstörung des T-Killersystems führt. Die Aktivität der Komplement- und Makrophagensysteme wird unterdrückt. Mit dem Virus infizierte Makrophagen und Monozyten sterben lange Zeit nicht ab, können das Virus jedoch nicht aus dem Körper entfernen. Schließlich werden aufgrund der strukturellen und antigenen Ähnlichkeit von gpl20 mit den Rezeptoren einiger Epithelzellen des Körpers (einschließlich Trophoblastenrezeptoren, die die Transplantatübertragung von HIV vermitteln) Antirezeptor-Antikörper mit einem breiten Wirkungsspektrum synthetisiert. Solche Antikörper können verschiedene zelluläre Rezeptoren blockieren und den Krankheitsverlauf durch Autoimmunerkrankungen erschweren. Die Folge einer HIV-Infektion ist die Zerstörung aller wichtigen Glieder des Immunsystems. Solche Patienten werden gegen eine Vielzahl von Mikroorganismen schutzlos. Dies führt zur Entwicklung opportunistischer Infektionen und Tumoren. Bei Patienten mit einer HIV-Infektion ist das Risiko erhöht, an mindestens drei Krebsarten zu erkranken: Kaposi-Sarkom; Karzinom (einschließlich Hautkrebs); B-Zell-Lymphom, das durch die maligne Transformation von B-Lymphozyten entsteht. HIV ist jedoch nicht nur lymphozytotrop, sondern auch neurotrop. Es dringt sowohl durch rezeptorvermittelte Endozytose als auch durch Phagozytose virusinfizierter Lymphoblasten durch Astrozyten in die Zellen des Zentralnervensystems (Astrozyten) ein. Bei der Interaktion des Virus mit Astrozyten entstehen zudem Symplasten, die die Ausbreitung des Erregers über interzelluläre Kanäle erleichtern. Das Virus kann lange Zeit in Makrophagen und Monozyten verbleiben, sodass diese als Reservoir und Verteiler im Körper dienen und in alle Gewebe eindringen können. Infizierte Makrophagen spielen eine wichtige Rolle bei der Einführung von HIV in das zentrale Nervensystem und dessen Schädigung. Bei 10 % der Patienten sind primäre klinische Syndrome mit einer Schädigung des zentralen Nervensystems verbunden und manifestieren sich als Demenz. HIV-Infizierte sind daher durch drei Krankheitsgruppen gekennzeichnet: opportunistische Infektionen,Tumorerkrankungen und Schäden des zentralen Nervensystems.
Epidemiologie der HIV-Infektion
Die Quelle einer HIV-Infektion ist ausschließlich der Mensch – ein Kranker oder ein Virusträger. Das Humane Immundefizienz-Virus (HIV) kommt in Blut, Sperma und Zervixflüssigkeit vor; bei stillenden Müttern in der Muttermilch. Die Ansteckung erfolgt sexuell, durch Blut und Blutzubereitungen sowie von der Mutter auf das Kind vor, während und nach der Geburt. Fälle einer Ansteckung mit dem Virus durch Nahrungsmittel, Getränke und Insektenstiche sind nicht bekannt.
Drogensucht trägt zur Verbreitung von AIDS bei. Die HIV-Inzidenz steigt jedes Jahr. Laut WHO haben sich zwischen 1980 und 2000 58 Millionen Menschen mit HIV infiziert. Allein im Jahr 2000 infizierten sich weltweit 5,3 Millionen Menschen, und 3 Millionen Menschen starben an AIDS. Am 1. Januar 2004 waren in Russland 264.000 HIV-Infizierte registriert. Die Hälfte aller HIV-Infizierten stirbt innerhalb von 11-12 Jahren nach der Infektion. Anfang 2004 lebten in Russland etwa 180 von 100.000 Einwohnern mit der Diagnose „HIV-Infektion“. Es wird prognostiziert, dass bei dieser Morbiditätsrate die Gesamtzahl der HIV-Infizierten in Russland bis 2012 2,5-3 Millionen betragen wird. Wie schwierig der Kampf gegen die HIV-Infektion ist, hat verschiedene Gründe: Erstens fehlen wirksame Behandlungsmethoden und gezielte Präventionsmethoden. Zweitens kann die Inkubationszeit einer HIV-Infektion mehr als 10 Jahre betragen. Ihre Dauer hängt vom Zeitpunkt der Aktivierung des T-Lymphozyten und des in seinem Chromosom enthaltenen DNA-Provirus ab. Es ist noch unklar, ob jeder Infizierte zwangsläufig an AIDS erkrankt oder ob eine langfristige Übertragung des Virus ohne Erkrankung möglich ist (was unwahrscheinlich erscheint). Schließlich gibt es mehrere humane Immundefizienzviren (HIV-1, HIV-2), deren antigene Unterschiede die Bildung einer Kreuzimmunität verhindern. Die Entdeckung des Affen-Immundefizienzvirus (SIV) gab Aufschluss über den Ursprung von HIV. SIV ähnelt HIV in seiner Genomorganisation, unterscheidet sich jedoch signifikant in seiner Nukleotidsequenz. HIV-2 nimmt in seinen serologischen Eigenschaften eine Zwischenstellung zwischen HIV-1 und SIV ein und steht SIV in seiner Nukleotidsequenz näher. In diesem Zusammenhang vermutete V. M. Schdanow, dass HIV-1, HIV-2 und SIV von einem gemeinsamen Vorfahren abstammen. Laut R. Gallo ist es möglich, dass eines der SIVs auf irgendeine Weise in den menschlichen Körper gelangte und dort eine Reihe von Mutationen durchlief, die zur Entstehung von HIV-1, HIV-2 und seinen anderen Formen führten.
Symptome einer HIV-Infektion
Das humane Immundefizienzvirus weist einige Merkmale auf, die die Pathogenese der Erkrankung maßgeblich bestimmen. Das Virus hat eine sehr hohe Reproduktionsrate, die durch seine regulatorischen Elemente bestimmt wird (im aktiven Stadium werden in 5 Minuten bis zu 5.000 Virionen synthetisiert). Aufgrund des Fusionsproteins (gp41) induziert das Virus durch die Fusion infizierter und nicht infizierter T-Helferzellen die Bildung ausgedehnter synzytialer Strukturen, was zu deren Massensterben führt. Die in großen Mengen gebildeten gpl20-Proteinmoleküle zirkulieren frei im Blut und binden an die Rezeptoren nicht infizierter T-Helferzellen, wodurch sie auch von T-Killerzellen erkannt und zerstört werden. Das Virus kann sich über interzelluläre Kanäle von Zelle zu Zelle ausbreiten, wodurch es für Antikörper schwer zugänglich wird.
Klinische Kriterien für eine HIV-Infektion
Bei Erwachsenen wird eine HIV-Infektion diagnostiziert, wenn mindestens zwei schwerwiegende Symptome in Kombination mit mindestens einem geringfügigen Symptom vorliegen und keine anderen bekannten Ursachen für eine Immunschwäche (Krebs, angeborene Immunschwäche, schwerer Hunger usw.) vorliegen. Zu den schwerwiegenden Symptomen zählen:
- Gewichtsverlust von 10 % oder mehr;
- ein anhaltender, intermittierender oder ständiger Fieberzustand;
- chronischer Durchfall.
Leichte Symptome: anhaltender Husten, generalisierte Dermatitis, rezidivierender Herpes zoster, orale und pharyngeale Candidose, chronischer Herpes simplex, generalisierte Lymphadenopathie. Die Diagnose AIDS wird gestellt, wenn nur ein Kaposi-Sarkom, eine Kryptokokkenmeningitis oder eine Pneumocystis-Pneumonie vorliegen. Das klinische Bild der Erkrankung wird durch die begleitende opportunistische Infektion beeinflusst.
Methoden zur Kultivierung des humanen Immundefizienzvirus (HIV)
HIV-1 und HIV-2 können in Zellen eines einzigen Klons von TCV4-Lymphozyten – H9 – kultiviert werden, der aus leukämischen TCV4-Lymphozyten gewonnen wird. Auch Monolayer-Kulturen von Astrozytenzellen, in denen sich HIV-1 gut reproduziert, können für diese Zwecke verwendet werden. Schimpansen sind unter den Tieren anfällig für HIV-1.
Die Resistenz des Virus in der äußeren Umgebung ist gering. Es stirbt unter dem Einfluss von Sonnenlicht und UV-Strahlung ab, wird bei 80 °C innerhalb von 30 Minuten zerstört, bei Behandlung mit handelsüblichen Desinfektionsmitteln innerhalb von 20–30 Minuten. Zur Desinfektion von virushaltigem Material sind mykobakterizide Desinfektionsmittel erforderlich, da diese gegen Mikroorganismen mit höchster Resistenz wirksam sind.
Labordiagnostik der HIV-Infektion
Die wichtigste Methode zur Diagnose des Virustransports und einer HIV-Infektion ist der Enzymimmunoassay. Da gpl20 jedoch strukturelle und antigenische Ähnlichkeiten mit Rezeptoren einiger menschlicher Zellen aufweist, einschließlich Rezeptoren, die Immunglobuline durch Epithelzellen der Schleimhäute transportieren, können im Körper Antikörper gegen gpl20 auftreten. In diesem Fall kann es zu falsch positiven ELISA-Ergebnissen kommen. Daher werden alle positiv reagierenden Seren der Probanden einer zusätzlichen Analyse mittels Immunoblotting oder Western Blotting unterzogen. Diese Methode basiert auf der Identifizierung der zu untersuchenden Antikörper nach ihrer elektrophoretischen Trennung und anschließender Prüfung mit markierten Anti-Spezies-Antikörpern. Die virologische Methode wird aufgrund der Komplexität der Viruskultivierung selten angewendet. Der H9-Lymphozytenklon wird verwendet, um virale Antigene zu gewinnen – die notwendigen Komponenten diagnostischer Testsysteme. Die CPR-Methode ermöglicht den Nachweis des Virus in einem frühen Stadium der Virämie.
Behandlung einer HIV-Infektion
Es ist notwendig, Medikamente zu finden oder zu synthetisieren, die die Aktivität der reversen Transkriptase (Revertase) oder der viralen Protease wirksam unterdrücken. Sie würden die Bildung von DNA-Proviren verhindern und (oder) die intrazelluläre Vermehrung des Virus hemmen. Die moderne Strategie zur Behandlung HIV-infizierter Patienten basiert auf dem Prinzip der kombinierten Anwendung von Medikamenten, die die virale Protease (eines der Medikamente) und die Revertase (zwei verschiedene Medikamente) hemmen – eine kombinierte (Dreifach-)Therapie. In Russland wird zur Behandlung HIV-infizierter Patienten die kombinierte Anwendung von zwei einheimischen Medikamenten empfohlen: Phosphazid und Crixivan, die die HIV-Reproduktion in frühen und späten Stadien der Reproduktion spezifisch unterdrücken, insbesondere bei reduzierter Azidothymidin-Aktivität.
Das Problem der spezifischen Prophylaxe besteht in der Notwendigkeit, einen Impfstoff zu entwickeln, der die Bildung einer wirksamen zellvermittelten Immunität auf der Basis virusspezifischer zytotoxischer Lymphozyten ohne nennenswerte Antikörperproduktion gewährleistet. Diese Immunität wird durch Thl-Helferzellen gewährleistet. Es ist möglich, dass Antikörper, auch virusneutralisierende, nicht nur eine HIV-Infektion nicht unterdrücken, sondern die zellvermittelte Immunität in hohem Maße unterdrücken. Daher muss ein Anti-HIV-Impfstoff vor allem zwei Hauptanforderungen erfüllen: a) absolut sicher sein und b) die Aktivität zytotoxischer T-Lymphozyten stimulieren. Die Wirksamkeit verschiedener Impfstoffvarianten, die aus abgetöteten (inaktivierten) Viren und aus einzelnen Antigenen mit hohen Schutzeigenschaften gewonnen werden, wird untersucht. Solche Antigene können entweder aus den Virionen selbst isoliert oder chemisch synthetisiert werden. Ein gentechnisch hergestellter Impfstoff wurde vorgeschlagen. Es handelt sich um ein rekombinantes Vacciniavirus, das HIV-Gene trägt, die für die Synthese von Antigenen mit starken immunogenen Eigenschaften verantwortlich sind. Die Frage nach der Wirksamkeit dieser Impfstoffe erfordert aufgrund der langen Inkubationszeit der HIV-Infektion und der hohen Variabilität des Erregers viel Zeit. Die Entwicklung eines hochwirksamen Impfstoffs gegen HIV ist ein dringendes grundlegendes Problem.

