
Alle iLive-Inhalte werden medizinisch überprüft oder auf ihre Richtigkeit überprüft.
Wir haben strenge Beschaffungsrichtlinien und verlinken nur zu seriösen Medienseiten, akademischen Forschungseinrichtungen und, wenn möglich, medizinisch begutachteten Studien. Beachten Sie, dass die Zahlen in Klammern ([1], [2] usw.) anklickbare Links zu diesen Studien sind.
Wenn Sie der Meinung sind, dass einer unserer Inhalte ungenau, veraltet oder auf andere Weise bedenklich ist, wählen Sie ihn aus und drücken Sie Strg + Eingabe.
Mitralstenose
Facharzt des Artikels
Zuletzt überprüft: 04.07.2025
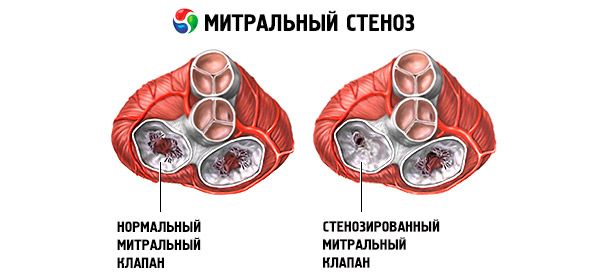
Bei einer Mitralstenose handelt es sich um eine Verengung der Mitralklappenöffnung, die den Blutfluss vom linken Vorhof zur linken Herzkammer verhindert. Die häufigste Ursache ist rheumatisches Fieber. Die Symptome entsprechen denen einer Herzinsuffizienz. Der Herzöffnungston und das diastolische Herzgeräusch lassen sich objektiv bestimmen. Die Diagnose wird durch körperliche Untersuchung und Echokardiographie gestellt. Die Prognose ist günstig. Die medikamentöse Behandlung der Mitralstenose umfasst Diuretika, Betablocker oder herzfrequenzsenkende Kalziumkanalblocker sowie Antikoagulanzien. Die chirurgische Behandlung schwererer Fälle einer Mitralstenose besteht aus einer Ballonvalvulotomie, einer Kommissurotomie oder einem Klappenersatz.
Epidemiologie
Fast immer ist eine Mitralstenose eine Folge eines akuten rheumatischen Fiebers. Die Inzidenz variiert erheblich: In Industrieländern werden 1-2 Fälle pro 100.000 Einwohner beobachtet, während in Entwicklungsländern (z. B. in Indien) rheumatische Mitralklappendefekte in 100-150 Fällen pro 100.000 Einwohner auftreten.
Ursachen Mitralstenose
Eine Mitralstenose ist fast immer eine Folge eines akuten rheumatischen Fiebers (RF). Eine isolierte, „reine“ Mitralstenose tritt bei 40 % aller Patienten mit rheumatischer Herzerkrankung auf; in anderen Fällen ist sie mit einer Insuffizienz und Schädigung anderer Klappen verbunden. Seltene Ursachen einer Mitralstenose sind rheumatische Erkrankungen (rheumatoide Arthritis, systemischer Lupus erythematodes) und eine Verkalkung des Mitralrings.
Pathogenese
Bei einer rheumatischen Mitralstenose kommt es zu Verdichtung, Fibrose und Verkalkung der Klappensegel sowie zu Verwachsungen entlang der Kommissuren und häufig zur Beteiligung der Sehnen. Normalerweise beträgt die Fläche der Mitralklappenöffnung 4–6 cm² , und der Druck im linken Vorhof überschreitet 5 mmHg nicht. Wenn sich die linke atrioventrikuläre Öffnung auf 2,5 cm² verengt , wird der normale Blutfluss vom linken Vorhof zum linken Ventrikel behindert und der Klappendruckgradient beginnt anzusteigen. Infolgedessen steigt der Druck im linken Vorhof auf 20–25 mmHg. Der entstehende Druckgradient zwischen dem linken Vorhof und dem linken Ventrikel fördert die Blutbewegung durch die verengte Öffnung.
Mit fortschreitender Stenose steigt der transmitrale Druckgradient an, was zur Aufrechterhaltung des diastolischen Blutflusses durch die Klappe beiträgt. Nach der Gorlin-Formel wird die Mitralklappenfläche (5MC) durch die Werte des transmitralen Gradienten (MG) und des mitralen Blutflusses (MBF) bestimmt:
BMK - MK/37.7 • ∆DM
Die wichtigste hämodynamische Folge von Mitralklappendefekten ist eine Stauung im Lungenkreislauf (PC). Bei einem moderaten Druckanstieg im linken Vorhof (nicht mehr als 25–30 mmHg) wird der Blutfluss im PC behindert. Der Druck in den Lungenvenen steigt an und wird über die Kapillaren auf die Lungenarterie übertragen, was zur Entwicklung einer venösen (oder passiven) pulmonalen Hypertonie führt. Bei einem Druckanstieg im linken Vorhof von mehr als 25–30 mmHg steigt das Risiko einer Ruptur der Lungenkapillaren und der Entwicklung eines alveolären Lungenödems. Um diesen Komplikationen vorzubeugen, tritt ein schützender Reflexkrampf der Lungenarteriolen auf. Infolgedessen nimmt der Blutfluss aus der rechten Herzkammer zu den Zellkapillaren ab, der Druck in der Lungenarterie steigt jedoch stark an (es entwickelt sich eine arterielle oder aktive pulmonale Hypertonie).
In den frühen Stadien der Erkrankung steigt der Druck in der Lungenarterie nur bei körperlicher oder emotionaler Belastung an, wenn der Blutfluss im ICC zunehmen sollte. Spätstadien der Erkrankung sind durch hohe Druckwerte in der Lungenarterie auch im Ruhezustand und einen noch stärkeren Anstieg unter Belastung gekennzeichnet. Langfristige pulmonale Hypertonie geht mit der Entwicklung proliferativer und sklerotischer Prozesse in der Wand der ICC-Arteriolen einher, die nach und nach obliterieren. Obwohl das Auftreten einer arteriellen pulmonalen Hypertonie als Kompensationsmechanismus betrachtet werden kann, sinkt aufgrund der Verringerung des kapillaren Blutflusses auch die Diffusionskapazität der Lunge stark, insbesondere unter Belastung, d. h. der Mechanismus der Progression einer pulmonalen Hypertonie aufgrund von Hypoxämie wird aktiviert. Alveoläre Hypoxie verursacht durch direkte und indirekte Mechanismen eine pulmonale Vasokonstriktion. Die direkte Wirkung der Hypoxie ist mit der Depolarisation glatter Gefäßmuskelzellen (vermittelt durch eine Funktionsänderung der Kaliumkanäle in den Zellmembranen) und deren Kontraktion verbunden. Der indirekte Mechanismus beinhaltet die Wirkung endogener Mediatoren (wie Leukotriene, Histamin, Serotonin, Angiotensin II und Katecholamine) auf die Gefäßwand. Chronische Hypoxämie führt zu einer endothelialen Dysfunktion, die mit einer verminderten Produktion endogener Relaxationsfaktoren wie Prostacyclin, Prostaglandin E2 und Stickoxid einhergeht. Eine langfristige endotheliale Dysfunktion führt zur Obliteration der Lungengefäße und zu Endothelschäden, was wiederum zu einer erhöhten Blutgerinnung, einer Proliferation glatter Muskelzellen mit Tendenz zur Thrombusbildung in situ und einem erhöhten Risiko thrombotischer Komplikationen mit der Entwicklung einer nachfolgenden chronischen postthrombotischen pulmonalen Hypertonie führt.
Die Ursachen der pulmonalen Hypertonie bei Mitralklappendefekten, einschließlich der Mitralstenose, sind:
- passive Druckübertragung vom linken Vorhof zum Lungenvenensystem;
- Krampf der Lungenarteriolen als Reaktion auf erhöhten Druck in den Lungenvenen;
- Schwellung der Wände kleiner Lungengefäße;
- Obliteration der Lungengefäße mit Endothelschädigung.
Der Mechanismus der Mitralstenose ist bis heute unklar. Einige Autoren sehen den Hauptfaktor in einer bestehenden (oft subklinischen) Valvulitis, während andere der Traumatisierung der Klappenstrukturen durch turbulenten Blutfluss mit thrombotischen Massen auf den Klappen, die der Verengung der Mitralöffnung zugrunde liegen, die Hauptrolle zuschreiben.
Symptome Mitralstenose
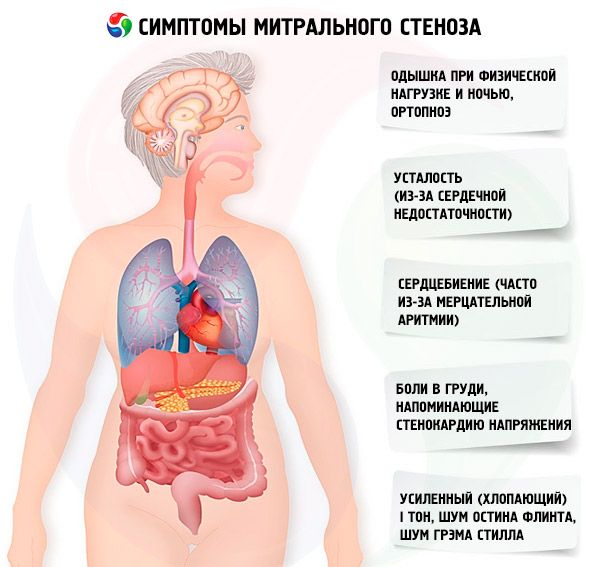
Die Symptome einer Mitralstenose korrelieren schlecht mit dem Schweregrad der Erkrankung, da die Erkrankung meist langsam fortschreitet und die Patienten ihre Aktivität unbemerkt reduzieren. Viele Patientinnen zeigen erst nach einer Schwangerschaft oder dem Auftreten von Vorhofflimmern klinische Symptome. Die ersten Symptome entsprechen meist denen einer Herzinsuffizienz (Belastungsdyspnoe, Orthopnoe, paroxysmale nächtliche Dyspnoe, Müdigkeit). Sie treten meist 15–40 Jahre nach dem rheumatischen Fieber auf, in Entwicklungsländern können die Symptome jedoch schon bei Kindern auftreten. Paroxysmales oder persistierendes Vorhofflimmern verschlimmert die bestehende diastolische Dysfunktion und verursacht bei schlecht eingestellter Kammerfrequenz ein Lungenödem und akute Dyspnoe.
Vorhofflimmern kann auch mit Herzklopfen einhergehen; bei 15 % der Patienten, die keine Antikoagulanzien erhalten, führt dies zu einer systemischen Embolie mit Extremitätenischämie oder Schlaganfall.
Zu den weniger häufigen Symptomen zählen Hämoptyse aufgrund von Rissen kleiner Lungengefäße und Lungenödem (insbesondere während der Schwangerschaft, wenn das Blutvolumen zunimmt); Dysphonie aufgrund einer Kompression des linken Nervus laryngeus recurrens durch einen vergrößerten linken Vorhof oder eine vergrößerte Lungenarterie (Ortner-Syndrom); Symptome einer pulmonalarteriellen Hypertonie und Rechtsherzinsuffizienz.
Die ersten Symptome einer Mitralstenose
Bei einer Mitralklappenöffnungsfläche >1,5 cm² können Symptome fehlen, jedoch führen eine Zunahme des transmitralen Blutflusses oder eine Verkürzung der diastolischen Füllungszeit zu einem starken Druckanstieg im linken Vorhof und zum Auftreten von Symptomen. Auslösende Faktoren für eine Dekompensation sind körperliche Anstrengung, emotionaler Stress, Vorhofflimmern, Schwangerschaft.
Das erste Symptom einer Mitralstenose (in etwa 20 % der Fälle) kann ein embolisches Ereignis sein, meist ein Schlaganfall mit der Entwicklung eines anhaltenden neurologischen Defizits bei 30-40 % der Patienten. Ein Drittel der Thromboembolien entwickelt sich innerhalb eines Monats nach Auftreten von Vorhofflimmern, zwei Drittel innerhalb des ersten Jahres. Die Emboliequelle sind in der Regel Thromben im linken Vorhof, insbesondere in dessen Anhang. Neben Schlaganfällen sind Embolien der Milz, der Nieren und der peripheren Arterien möglich.
Beim Sinusrhythmus wird das Embolierisiko bestimmt durch:
- Alter;
- Thrombose des linken Vorhofs;
- Mitralöffnungsbereich;
- gleichzeitige Aorteninsuffizienz.
Bei permanentem Vorhofflimmern steigt das Embolierisiko deutlich an, insbesondere wenn der Patient bereits ähnliche Komplikationen in der Anamnese aufweist. Auch eine spontane Kontrastverstärkung des linken Vorhofs bei der transösophagealen Echokardiographie gilt als Risikofaktor für eine systemische Embolie.
Bei erhöhtem Druck im ICC (insbesondere im Stadium der passiven pulmonalen Hypertonie) treten Beschwerden über Kurzatmigkeit bei körperlicher Anstrengung auf. Mit fortschreitender Stenose tritt Kurzatmigkeit bei geringerer Belastung auf. Es ist zu beachten, dass Beschwerden über Kurzatmigkeit auch bei unbestrittener pulmonaler Hypertonie fehlen können, da der Patient möglicherweise eine sitzende Lebensweise führt oder unbewusst seine tägliche körperliche Aktivität einschränkt. Paroxysmale nächtliche Dyspnoe tritt als Folge einer Blutstagnation im ICC im Liegen auf und ist Ausdruck eines interstitiellen Lungenödems und eines starken Blutdruckanstiegs in den Gefäßen des ICC. Aufgrund eines Druckanstiegs in den Lungenkapillaren und der Exsudation von Plasma und Erythrozyten in das Lumen der Alveolen kann sich eine Hämoptyse entwickeln.
Patienten klagen häufig über erhöhte Müdigkeit, Herzklopfen und unregelmäßigen Herzschlag. Eine vorübergehende Heiserkeit (Ortner-Syndrom) kann auftreten. Dieses Syndrom entsteht durch die Kompression des Nervus recurrens durch den vergrößerten linken Vorhof.
Patienten mit Mitralstenose leiden häufig unter anginaähnlichen Brustschmerzen. Die wahrscheinlichsten Ursachen sind pulmonale Hypertonie und Rechtsherzhypertrophie.
Bei schwerer Dekompensation können eine Facies mitralis (eine bläulich-rosa Röte der Wangen, die mit einer verringerten Auswurffraktion, systemischer Vasokonstriktion und Rechtsherzinsuffizienz einhergeht), epigastrische Pulsation und Anzeichen einer Rechtsherzinsuffizienz beobachtet werden.
 [ 21 ]
[ 21 ]
Inspektion und Auskultation
Bei Inspektion und Palpation lassen sich deutliche Herztöne I (S1) und II (S2) erkennen. S1 lässt sich am besten an der Herzspitze und S2 am linken oberen Sternalrand ertasten. Die pulmonale Komponente von S3 (P) ist für den Impuls verantwortlich und ist eine Folge der pulmonalarteriellen Hypertonie. Sichtbare RV-Pulsation, tastbar am linken Sternalrand, kann eine Jugularvenenüberlastung begleiten, wenn eine pulmonalarterielle Hypertonie vorliegt und sich eine rechtsventrikuläre diastolische Dysfunktion entwickelt.
Der apikale Impuls bei Mitralstenose ist meist normal oder vermindert, was die normale Funktion des linken Ventrikels und eine Volumenverringerung widerspiegelt. Ein tastbarer 1. Tonus im präkordialen Bereich weist auf eine erhaltene Beweglichkeit des vorderen Mitralklappensegels hin. In der rehseitigen Position kann ein diastolischer Tremor ertastet werden. Mit der Entwicklung einer pulmonalen Hypertonie wird ein Herzimpuls entlang der rechten Brustbeingrenze festgestellt.
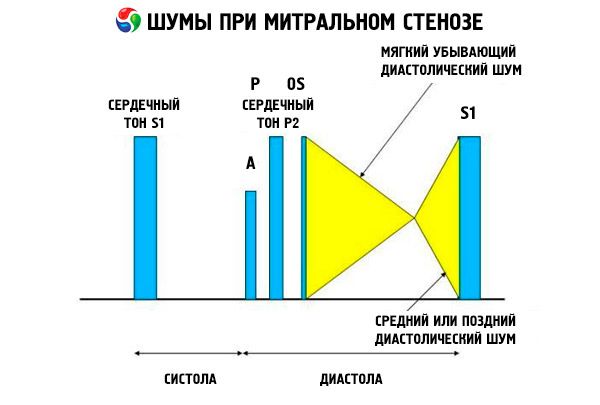
Das auskultatorische Bild einer Mitralstenose ist recht charakteristisch und umfasst die folgenden Anzeichen:
- verstärkter (klatschender) 1. Ton, dessen Intensität mit fortschreitender Stenose abnimmt;
- der auf den zweiten Ton folgende Öffnungston der Mitralklappe, der bei Klappenverkalkung verschwindet;
- diastolisches Herzgeräusch mit Maximum an der Herzspitze (mesodiastolisch, präsystolisch, pandiastolisch), das in Linksseitenlage abgehört werden muss.
Die Auskultation zeigt ein lautes S1, verursacht durch das abrupte Schließen der Klappensegel der stenotischen Mitralklappe, ähnlich einem sich „aufblasenden“ Segel; dieses Phänomen ist am besten an der Herzspitze zu hören. Ein gespaltenes S1 mit vergrößertem P1 aufgrund einer pulmonalarteriellen Hypertonie ist ebenfalls häufig zu hören. Am deutlichsten ist das frühdiastolische Schnappen der Klappensegel beim Öffnen in den linken Ventrikel (LV), das am linken unteren Sternalrand am lautesten ist. Es wird von einem tiefen, crescendo-rumpelnden diastolischen Herzgeräusch begleitet, das am besten mit einem trichterförmigen Stethoskop an der Herzspitze (oder über dem tastbaren Herzspitzenstoß) bei Endexspiration zu hören ist, wenn der Patient auf der linken Seite liegt. Das Öffnungsgeräusch kann leise sein oder fehlen, wenn die Mitralklappe sklerotisch, fibrotisch oder verdickt ist. Das Klicken rückt näher an das P1 (und verlängert die Dauer des Geräusches), wenn der Schweregrad der Mitralstenose zunimmt und der linksatriale Druck steigt. Das diastolische Herzgeräusch verstärkt sich beim Valsalva-Manöver (wenn Blut in den linken Vorhof fließt), nach körperlicher Anstrengung sowie beim Hocken und Händeschütteln. Es kann weniger ausgeprägt sein, wenn der vergrößerte rechte Ventrikel den linken Ventrikel nach hinten verdrängt und wenn andere Erkrankungen (pulmonalarterielle Hypertonie, Rechtsklappenerkrankung, Vorhofflimmern mit hoher Kammerfrequenz) den Blutfluss durch die Mitralklappe reduzieren. Der präsystolische Anstieg ist auf die Verengung der Mitralklappenöffnung während der linksventrikulären Kontraktion zurückzuführen, die auch bei Vorhofflimmern auftritt, jedoch nur am Ende der kurzen Diastole, wenn der linksatriale Druck noch hoch ist.
Die folgenden diastolischen Geräusche können mit dem Geräusch einer Mitralstenose verbunden sein:
- Graham-Still-Geräusch (ein leises, abschwellendes diastolisches Geräusch, das am besten am linken Brustbeinrand zu hören ist und durch eine Pulmonalklappeninsuffizienz aufgrund schwerer pulmonaler Hypertonie verursacht wird);
- Austin-Flint-Geräusch (ein mittel- bis spätdiastolisches Geräusch, das an der Herzspitze zu hören ist und durch die Wirkung des Aorteninsuffizienzflusses auf die Mitralklappensegel verursacht wird), wenn eine rheumatische Karditis die Mitral- und Aortenklappen betrifft.
Zu den Erkrankungen, die diastolische Herzgeräusche verursachen, die denen einer Mitralstenose ähneln, zählen die Mitralklappeninsuffizienz (aufgrund eines großen Blutflusses durch die Mitralklappenöffnung), die Aorteninsuffizienz (die ein Austin-Flint-Geräusch verursacht) und das Vorhofmyxom (das ein Herzgeräusch verursacht, dessen Lautstärke und Position sich typischerweise mit jedem Herzschlag ändert).
Eine Mitralstenose kann Symptome einer pulmonalen Herzerkrankung hervorrufen. Das klassische Symptom einer Facies mitralis (pflaumenfarbene Hautrötung im Jochbeinbereich) tritt nur bei eingeschränkter Herzfunktion und ausgeprägter pulmonaler Hypertonie auf. Ursachen einer Facies mitralis sind erweiterte Hautgefäße und chronische Hypoxämie.
Manchmal sind die ersten Symptome einer Mitralstenose Manifestationen eines embolischen Schlaganfalls oder einer Endokarditis. Letztere tritt selten bei einer Mitralstenose auf, die nicht von einer Mitralklappeninsuffizienz begleitet wird.
 [ 22 ], [ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ]
[ 22 ], [ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ]
Klinische Manifestationen der pulmonalen Hypertonie bei Mitralstenose
Die ersten Symptome einer pulmonalen Hypertonie sind unspezifisch, was eine frühzeitige Diagnose erheblich erschwert.
Dyspnoe wird sowohl durch das Vorhandensein von pulmonaler Hypertonie als auch durch die Unfähigkeit des Herzens verursacht, das Herzzeitvolumen während des Trainings zu erhöhen. Dyspnoe ist in der Regel inspiratorischer Natur, ist zu Beginn der Krankheit inkonsistent und tritt nur bei mäßiger körperlicher Anstrengung auf. Wenn der Druck in der Lungenarterie steigt, tritt sie bei minimaler körperlicher Anstrengung auf und kann auch in Ruhe vorhanden sein. Bei hoher pulmonaler Hypertonie kann ein trockener Husten auftreten. Es sollte beachtet werden, dass Patienten ihre körperliche Aktivität unbewusst einschränken und sich an einen bestimmten Lebensstil anpassen können, sodass Beschwerden über Dyspnoe manchmal auch bei unbestrittener pulmonaler Hypertonie fehlen.
Schwäche, erhöhte Müdigkeit – Ursachen dieser Beschwerden können ein fixiertes Herzzeitvolumen (die in die Aorta ausgestoßene Blutmenge nimmt bei körperlicher Anstrengung nicht zu), ein erhöhter Lungengefäßwiderstand sowie eine verminderte Durchblutung peripherer Organe und Skelettmuskulatur aufgrund einer gestörten peripheren Durchblutung sein.
Schwindel und Ohnmacht sind die Folge einer hypoxischen Enzephalopathie und werden meist durch körperliche Anstrengung hervorgerufen.
Anhaltende Schmerzen hinter und links des Brustbeins werden durch eine Überdehnung der Lungenarterie sowie eine Minderdurchblutung des hypertrophierten Myokards (relative Koronarinsuffizienz) verursacht.
Herzklopfen und unregelmäßiger Herzschlag. Diese Symptome stehen im Zusammenhang mit dem häufigen Auftreten von Vorhofflimmern.
Hämoptyse entsteht durch eine Ruptur der pulmonal-bronchialen Anastomosen unter dem Einfluss einer hohen venösen pulmonalen Hypertonie und kann auch eine Folge eines erhöhten Drucks in den Lungenkapillaren und des Austretens von Plasma und Erythrozyten in das Lumen der Alveolen sein. Hämoptyse kann auch ein Symptom einer Lungenembolie und eines Lungeninfarkts sein.
Zur Charakterisierung des Schweregrads der pulmonalen Hypertonie wird die von der WHO für Patienten mit Kreislaufversagen vorgeschlagene Funktionsklassifikation verwendet:
- Klasse I - Patienten mit pulmonaler Hypertonie, jedoch ohne Einschränkung der körperlichen Aktivität. Normale körperliche Aktivität verursacht keine Kurzatmigkeit, Schwäche, Brustschmerzen oder Schwindel;
- Klasse II - Patienten mit pulmonaler Hypertonie, die zu einer gewissen Verringerung der körperlichen Aktivität führt. In Ruhe fühlen sie sich wohl, aber normale körperliche Aktivität geht mit dem Auftreten von Kurzatmigkeit, Schwäche, Brustschmerzen und Schwindel einher;
- Klasse III - Patienten mit pulmonaler Hypertonie, die zu einer deutlichen Einschränkung der körperlichen Aktivität führt. In Ruhe fühlen sie sich wohl, aber leichte körperliche Aktivität verursacht Kurzatmigkeit, Schwäche, Brustschmerzen und Schwindel;
- Klasse IV – Patienten mit pulmonaler Hypertonie, die ohne die aufgeführten Symptome keine körperliche Aktivität ausüben können. Kurzatmigkeit oder Schwäche treten manchmal auch in Ruhe auf, die Beschwerden nehmen bei minimaler körperlicher Aktivität zu.
Wo tut es weh?
Formen
Mitralstenosen werden nach Schweregrad klassifiziert (ACC/AHA/ASE-Leitlinienaktualisierung 2003 für die klinische Anwendung der Echokardiographie).
Klassifizierung der Mitralstenose nach Grad
Grad der Stenose |
Mitralöffnungsfläche, cm2 |
Transmissionsgradient, mmHg |
Systolischer Druck in der Lungenarterie, mm Hg |
Einfach |
>1,5 |
<5 |
<30 |
Mäßig |
1,0-1,5 |
5-10 |
30-50 |
Schwer |
<1 0 |
>10 |
>50 |
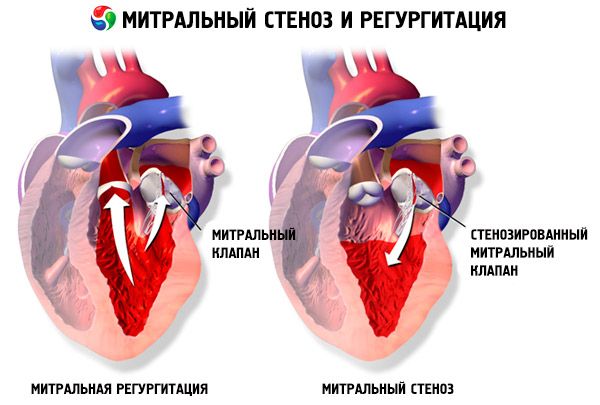
Bei einer Mitralstenose verdicken und unbeweglich die Mitralklappensegel, und die Mitralklappenöffnung verengt sich aufgrund der Fusion der Kommissuren. Die häufigste Ursache ist rheumatisches Fieber, obwohl sich die meisten Patienten nicht an die Erkrankung erinnern. Seltenere Ursachen sind eine angeborene Mitralstenose, eine infektiöse Endokarditis, ein systemischer Lupus erythematodes, ein Vorhofmyxom, eine rheumatoide Arthritis und ein malignes Karzinoidsyndrom mit Rechts-Links-Vorhof-Shunt. Eine Mitralklappeninsuffizienz (MI) kann zusammen mit einer Mitralstenose auftreten, wenn die Klappe nicht vollständig schließt. Viele Patienten mit einer Mitralstenose aufgrund von rheumatischem Fieber haben auch eine Aorteninsuffizienz.
Die normale Öffnungsfläche der Mitralklappe beträgt 4–6 cm² . Eine Fläche von 1–2 cm² weist auf eine mittelschwere bis schwere Mitralstenose hin und verursacht häufig klinische Symptome bei körperlicher Belastung. Eine Fläche < 1 cm² stellt eine kritische Stenose dar und kann auch im Ruhezustand Symptome verursachen. Größe und Druck im linken Vorhof nehmen progressiv zu, um die Mitralstenose zu kompensieren. Auch der pulmonalvenöse und kapilläre Druck steigt an und kann eine sekundäre pulmonale Hypertonie verursachen, die zu Rechtsherzinsuffizienz sowie Trikuspidal- und Pulmonalklappeninsuffizienz führt. Die Progression der Erkrankung ist unterschiedlich.
Eine Pathologie der Herzklappen mit Erweiterung des linken Vorhofs begünstigt die Entwicklung von Vorhofflimmern (VHF) und Thromboembolien.
Diagnose Mitralstenose
Die vorläufige Diagnose wird klinisch gestellt und durch eine Echokardiographie bestätigt. Die zweidimensionale Echokardiographie liefert Informationen über den Grad der Klappenverkalkung, die Größe des linken Vorhofs und die Stenose. Die Doppler-Echokardiographie liefert Informationen über den transvalvulären Gradienten und den pulmonalarteriellen Druck. Die transösophageale Echokardiographie kann zum Nachweis oder Ausschluss kleiner Thromben im linken Vorhof, insbesondere im linken Vorhofohr, eingesetzt werden, die bei einer transthorakalen Untersuchung oft nicht erkennbar sind.
Im Röntgenbild des Thorax ist typischerweise eine Verwischung des linken Herzrandes aufgrund eines erweiterten linken Vorhofohrs erkennbar. Der Hauptstamm der Pulmonalarterie kann sichtbar sein; der Durchmesser der absteigenden rechten Pulmonalarterie überschreitet bei schwerer pulmonaler Hypertonie 16 mm. Die Pulmonalvenen der Oberlappen können erweitert sein, da die Venen der Unterlappen komprimiert sind, was zu einer Stauung im Oberlappen führt. Entlang der rechten Herzkontur kann ein Doppelschatten eines vergrößerten linken Vorhofs erkennbar sein. Horizontale Linien in den unteren hinteren Lungenfeldern (Kerley-Linien) weisen auf ein interstitielles Ödem in Verbindung mit hohem Druck im linken Vorhof hin.
Eine Herzkatheteruntersuchung wird nur zur präoperativen Erkennung einer koronaren Herzkrankheit verordnet: Dabei können die Vergrößerung des linken Vorhofs, der Druck in den Lungenarterien und der Klappenbereich beurteilt werden.
Das EKG des Patienten ist gekennzeichnet durch das Auftreten einer P-Mitralklappe (breit, mit PQ-Kerbe), eine Abweichung der elektrischen Achse des Herzens nach rechts, insbesondere bei der Entwicklung einer pulmonalen Hypertonie, sowie eine Hypertrophie der rechten (bei isolierter Mitralstenose) und linken (bei Kombination mit Mitralinsuffizienz) Herzkammer.
Der Schweregrad der Stenose wird mittels Doppler-Ultraschall beurteilt. Der mittlere transmitrale Druckgradient und die Fläche der Mitralklappe lassen sich mithilfe der Dauerstrich-Technik sehr genau bestimmen. Von großer Bedeutung ist die Beurteilung des Ausmaßes der pulmonalen Hypertonie sowie der gleichzeitigen Mitral- und Aorteninsuffizienz.
Zusätzliche Informationen können durch eine Belastungsuntersuchung (Stress-Echokardiographie) mit Aufzeichnung des transmitralen und trikuspidalen Blutflusses gewonnen werden. Bei einer Mitralklappenfläche < 1,5 cm² und einem Druckgradienten > 50 mmHg (nach Belastung) sollte eine Ballon-Mitralvalvuloplastie erwogen werden.
Darüber hinaus ist der spontane Echokontrast während der transösophagealen Echokardiographie ein unabhängiger Prädiktor für embolische Komplikationen bei Patienten mit Mitralstenose.
Die transösophageale Echokardiographie ermöglicht die Abklärung des Vorhandenseins oder Fehlens eines linksatrialen Thrombus sowie die Abklärung des Ausmaßes der Mitralklappeninsuffizienz bei geplanter Ballon-Mitralklappenvalvuloplastie. Darüber hinaus ermöglicht die transösophageale Untersuchung eine genaue Beurteilung des Zustands des Klappenapparates und des Schweregrads der Veränderungen in subvalvulären Strukturen sowie die Einschätzung der Wahrscheinlichkeit einer Restenose.
Eine Herz- und Gefäßkatheterisierung wird durchgeführt, wenn ein chirurgischer Eingriff geplant ist und nichtinvasive Testdaten kein eindeutiges Ergebnis liefern. Die direkte Messung des linken Vorhof- und Ventrikeldrucks erfordert eine transseptale Katheterisierung, die mit einem ungerechtfertigten Risiko verbunden ist. Eine indirekte Methode zur Messung des linken Vorhofdrucks ist der pulmonalarterielle Verschlussdruck.
Was muss untersucht werden?
Differenzialdiagnose
Bei sorgfältiger Untersuchung ist die Diagnose einer Mitralklappenerkrankung in der Regel zweifelsfrei.
Die Mitralstenose wird außerdem vom Myxom des linken Vorhofs, anderen Klappenfehlern (Mitralinsuffizienz, Trikuspidalstenose), Vorhofseptumdefekt, Pulmonalvenenstenose und angeborener Mitralstenose unterschieden.
 [ 51 ], [ 52 ], [ 53 ], [ 54 ], [ 55 ], [ 56 ], [ 57 ]
[ 51 ], [ 52 ], [ 53 ], [ 54 ], [ 55 ], [ 56 ], [ 57 ]
Beispiele für die Formulierung von Diagnosen
- Rheumatische Herzerkrankung. Kombinierte Mitralklappenerkrankung mit prädominanter Stenose der linken atrioventrikulären Öffnung Grad III. Vorhofflimmern, permanente Form, Tachysystole. Mäßige pulmonale Hypertonie. NK PB Stadium, III FC.
- Rheumatische Herzerkrankung. Kombinierter Mitralklappendefekt. Mitralklappenersatz (Medinzh – 23) vom TT.MM.GG. NK Stadium IIA, II FC.
Wen kann ich kontaktieren?
Behandlung Mitralstenose
Die Hauptziele der Behandlung von Patienten mit Mitralstenose sind die Verbesserung der Prognose und Erhöhung der Lebenserwartung sowie die Linderung der Krankheitssymptome.
Asymptomatischen Patienten wird empfohlen, intensive körperliche Aktivitäten einzuschränken. Bei Dekompensation und chronischer Herzinsuffizienz wird eine Natriumbeschränkung in der Nahrung empfohlen.
Medikamentöse Behandlung der Mitralstenose
Eine medikamentöse Therapie kann die Symptome einer Mitralstenose lindern, beispielsweise zur Vorbereitung auf eine Operation. Diuretika senken den Druck im linken Vorhof und lindern die mit der Mitralstenose verbundenen Symptome. Allerdings sollten Diuretika mit Vorsicht angewendet werden, da sie das Herzzeitvolumen verringern können. Betablocker und Kalziumkanalblocker (Verapamil und Diltiazem) senken die Herzfrequenz in Ruhe und bei Belastung und verbessern die Füllung des linken Ventrikels durch Verlängerung der Diastole. Diese Medikamente können die mit körperlicher Aktivität verbundenen Symptome lindern und sind insbesondere bei Sinustachykardie und Vorhofflimmern angezeigt.
Vorhofflimmern ist eine häufige Komplikation einer Mitralstenose, insbesondere bei älteren Menschen. Das Risiko einer Thromboembolie bei Vorhofflimmern ist signifikant erhöht (die 10-Jahres-Überlebensrate beträgt 25 % der Patienten im Vergleich zu 46 % bei Patienten mit Sinusrhythmus).
Indirekte Antikoagulanzien (Warfarin, Anfangsdosis 2,5–5,0 mg, unter INR-Kontrolle) sind angezeigt;
- alle Patienten mit Mitralstenose, kompliziert durch Vorhofflimmern (paroxysmale, anhaltende oder permanente Form);
- Patienten mit einer Vorgeschichte embolischer Ereignisse, auch mit erhaltenem Sinusrhythmus;
- Patienten mit einem Thrombus im linken Vorhof;
- Patienten mit schwerer Mitralstenose und Patienten, deren linker Vorhof >55 mm groß ist.
Die Behandlung erfolgt unter Kontrolle des INR-Wertes, dessen Zielwerte zwischen 2 und 3 liegen. Wenn der Patient trotz Antikoagulanzienbehandlung embolische Komplikationen entwickelt, wird empfohlen, Acetylsalicylsäure in einer Dosis von 75-100 mg / Tag hinzuzufügen (Alternativen sind Dipyridamol oder Clopidogrel). Es ist zu beachten, dass keine randomisierten kontrollierten Studien zur Anwendung von Antikoagulanzien bei Patienten mit Mitralstenose durchgeführt wurden. Empfehlungen basieren auf der Extrapolation von Daten, die in Kohorten von Patienten mit Vorhofflimmern gewonnen wurden.
Da die Entwicklung von Vorhofflimmern bei Patienten mit Mitralstenose mit einer Dekompensation einhergeht, ist eine Behandlung zur Verlangsamung des ventrikulären Rhythmus von größter Bedeutung. Wie bereits erwähnt, können Betablocker, Verapamil oder Diltiazem die Medikamente der Wahl sein. Auch Digoxin kann eingesetzt werden, allerdings ist sein geringes therapeutisches Intervall und seine schlechtere Fähigkeit, eine Beschleunigung der Herzfrequenz bei Belastung zu verhindern, im Vergleich zu Betablockern grenzwertig. Auch die elektrische Kardioversion ist bei persistierendem Vorhofflimmern nur bedingt sinnvoll, da ohne chirurgische Behandlung des Vorhofflimmerns die Wahrscheinlichkeit eines Rückfalls sehr hoch ist.
Chirurgische Behandlung der Mitralstenose
Die Hauptbehandlungsmethode einer Mitralstenose ist die chirurgische Behandlung, da es heute keine medikamentöse Behandlung gibt, die das Fortschreiten der Stenose verlangsamen kann.
Bei Patienten mit schwereren Symptomen oder Anzeichen einer pulmonal-arteriellen Hypertonie ist eine Valvulotomie, Kommissurotomie oder ein Klappenersatz erforderlich.
Das Verfahren der Wahl ist die perkutane Ballon-Mitralklappenvalvuloplastie. Dies ist die wichtigste Methode zur chirurgischen Behandlung der Mitralstenose. Darüber hinaus werden die offene Kommissurotomie und der Mitralklappenersatz eingesetzt.
Die perkutane Ballonvalvulotomie ist die bevorzugte Methode für jüngere Patienten, ältere Patienten, die invasivere Eingriffe nicht vertragen, und Patienten ohne signifikante Klappenverkalkung, subvalvuläre Deformität, linksatriale Thromben oder signifikante Mitralklappeninsuffizienz. Bei diesem Verfahren wird unter echokardiographischer Kontrolle ein Ballon über das Vorhofseptum vom rechten zum linken Vorhof geführt und aufgeblasen, um die verschmolzenen Mitralklappensegel zu trennen. Die Ergebnisse sind mit denen invasiverer Eingriffe vergleichbar. Komplikationen sind selten und umfassen Mitralklappeninsuffizienz, Embolie, linksventrikuläre Perforation und einen Vorhofseptumdefekt, der bei großem interatrialen Druckunterschied wahrscheinlich persistiert.
Die perkutane Ballon-Mitralvalvuloplastie ist für folgende Patientengruppen mit einer Mitralklappenöffnungsfläche von weniger als 1,5 cm 2 angezeigt:
- dekompensierte Patienten mit günstigen Merkmalen für eine perkutane Mitralklappenvalvuloplastie (Klasse I, Evidenzgrad B);
- dekompensierte Patienten mit Kontraindikationen für eine chirurgische Behandlung oder hohem Operationsrisiko (Klasse I, Evidenzgrad! IC);
- bei geplanter primärer chirurgischer Korrektur des Defekts bei Patienten mit ungeeigneter Klappenmorphologie, aber zufriedenstellenden klinischen Merkmalen (Klasse IIa, Evidenzgrad C);
- „asymptomatische“ Patienten mit geeigneten morphologischen und klinischen Merkmalen, hohem Risiko für thromboembolische Komplikationen oder hohem Risiko einer Dekompensation hämodynamischer Parameter;
- mit embolischen Komplikationen in der Vorgeschichte (Klasse IIa, Evidenzgrad C);
- mit dem Phänomen des spontanen Echokontrasts im linken Vorhof (Klasse IIa, Evidenzgrad C);
- mit permanentem oder paroxysmalem Vorhofflimmern (Klasse IIa, Evidenzgrad C);
- mit einem systolischen Lungenarteriendruck von über 50 mmHg (Klasse IIa, Evidenzgrad C);
- wenn größere nicht-kardiale Operationen erforderlich sind (Klasse IIa, Evidenzgrad C);
- bei Schwangerschaftsplanung (Klasse IIa, Evidenzgrad C).
Geeignete Merkmale für die perkutane Mitralvalvuloplastie sind das Fehlen der folgenden Merkmale:
- Klinik: hohes Alter, Kommissurotomie in der Vorgeschichte, Herzinsuffizienz der funktionellen Klasse IV, Vorhofflimmern, schwere pulmonale Hypertonie;
- Morphologisch: Mitralklappenverkalkung jeglichen Grades, beurteilt durch Fluorographie, sehr kleine Mitralklappenfläche, schwere Trikuspidalinsuffizienz.
Patienten mit schwerer subvalvulärer Erkrankung, Klappenverkalkung oder Thromben im linken Vorhof können Kandidaten für eine Kommissurotomie sein. Dabei werden die verschmolzenen Mitralklappensegel mithilfe eines Dilatators durch den linken Vorhof und die linke Herzkammer (geschlossene Kommissurotomie) oder manuell (offene Kommissurotomie) getrennt. Beide Verfahren erfordern eine Thorakotomie. Die Wahl der Methode hängt von der chirurgischen Situation und dem Grad der Fibrose und Verkalkung ab.
Eine Mitralklappenplastik (offene Kommissurotomie) oder ein Mitralklappenersatz wird bei folgenden Indikationen der Klasse I durchgeführt.
Bei Vorliegen einer Herzinsuffizienz III-IV FC und mittelschwerer oder schwerer Mitralstenose in Fällen, in denen:
- eine Mitralklappen-Ballonvalvuloplastie kann nicht durchgeführt werden;
- Eine Mitralklappen-Ballonvalvuloplastie ist kontraindiziert, wenn trotz der Anwendung von Antikoagulanzien ein Thrombus im linken Vorhof vorliegt oder wenn gleichzeitig eine mittelschwere oder schwere Mitralklappeninsuffizienz vorliegt.
- Die Klappenmorphologie ist für eine Mitralklappen-Ballonvalvuloplastie nicht geeignet.
Bei mittelschwerer bis schwerer Mitralstenose und gleichzeitiger mittelschwerer bis schwerer Mitralklappeninsuffizienz (ein Klappenersatz ist angezeigt, wenn eine Klappenreparatur nicht möglich ist).
Der Klappenersatz ist der letzte Ausweg. Er wird Patienten verschrieben, deren Mitralklappenfläche < 1,5 cm² , mittelschwere bis schwere Symptome und eine Klappenerkrankung (z. B. Fibrose) aufweist, die den Einsatz anderer Methoden ausschließt.
Ein Mitralklappenersatz ist bei schwerer Mitralstenose und schwerer pulmonaler Hypertonie (systolischer Pulmonalarteriendruck über 60 mmHg) sowie Symptomen einer Herzinsuffizienz der Klassen I-II ratsam (Indikationen Klasse IIa), es sei denn, eine Mitralklappenballonvalvuloplastie oder ein Mitralklappenersatz wird vorgeschlagen. Patienten mit Mitralstenose, die keine Symptome einer Dekompensation aufweisen, sollten jährlich untersucht werden. Die Untersuchung umfasst die Erhebung der Beschwerden, Anamnese, Untersuchung, Röntgenaufnahme des Brustkorbs und EKG. Wenn sich der Zustand des Patienten im Laufe des letzten Zeitraums verändert hat oder die Ergebnisse der vorherigen Untersuchung auf eine schwere Mitralstenose hinweisen, ist eine Echokardiographie angezeigt. In allen anderen Fällen ist eine jährliche Echokardiographie nicht erforderlich. Wenn der Patient über Herzklopfen klagt, wird eine 24-stündige (Holter-)EKG-Überwachung empfohlen, um Paroxysmen von Vorhofflimmern zu erkennen.
Während der Schwangerschaft können Patientinnen mit leichter bis mittelschwerer Stenose nur medikamentös behandelt werden. Die Anwendung von Diuretika und Betablockern ist unbedenklich. Ist eine Antikoagulanzienbehandlung erforderlich, werden den Patientinnen Heparin-Injektionen verschrieben, da Warfarin kontraindiziert ist.
Verhütung
Das wichtigste Thema der Taktik der weiteren Behandlung von Patienten mit Mitralstenose ist die Vorbeugung von Rückfällen von rheumatischem Fieber mit lebenslang verschriebenen Penicillin-Medikamenten mit verlängerter Wirkstofffreisetzung sowie für alle Patienten nach chirurgischer Korrektur des Defekts (einschließlich zur Vorbeugung einer infektiösen Endokarditis). Benzathinbenzylpenicillin wird einmal monatlich in einer Dosis von 2,4 Millionen Einheiten für Erwachsene und 1,2 Millionen Einheiten für Kinder intramuskulär verschrieben.
Bei allen Patienten mit Mitralstenose ist die Behandlung zur sekundären Prävention von Rückfällen des rheumatischen Fiebers angezeigt. Darüber hinaus ist sie bei allen Patienten zur Vorbeugung einer infektiösen Endokarditis angezeigt.
Asymptomatische Patienten benötigen bis zum Alter von 25–30 Jahren lediglich eine Prophylaxe gegen wiederkehrendes rheumatisches Fieber [z. B. intramuskuläre Injektionen von Benzylpenicillin (steriles Natriumsalz von Penicillin G) 1,2 Millionen Einheiten alle 3 oder 4 Wochen] sowie eine Endokarditisprophylaxe vor riskanten Eingriffen.
Prognose
Der natürliche Verlauf einer Mitralstenose variiert, doch zwischen Symptombeginn und schwerer Behinderung vergehen etwa 7 bis 9 Jahre. Der Behandlungserfolg hängt vom Alter des Patienten, seinem Funktionsstatus, der pulmonal-arteriellen Hypertonie und dem Grad des Vorhofflimmerns ab. Die Ergebnisse von Valvulotomie und Kommissurotomie sind gleichwertig; beide Methoden stellen bei 95 % der Patienten die Klappenfunktion wieder her. Allerdings verschlechtert sich die Funktion bei den meisten Patienten mit der Zeit, und viele benötigen einen erneuten Eingriff. Zu den Risikofaktoren für den Tod zählen Vorhofflimmern und pulmonale Hypertonie. Die Todesursache ist in der Regel Herzversagen oder eine Lungen- bzw. zerebrovaskuläre Embolie.
Die Mitralstenose schreitet in der Regel langsam voran und weist eine lange Kompensationsphase auf. Mehr als 80 % der Patienten überleben 10 Jahre ohne Symptome oder mäßige Anzeichen einer Herzinsuffizienz (I-II FC gemäß NUHA). Die 10-Jahres-Überlebensrate dekompensierter und nicht operierter Patienten ist deutlich schlechter und liegt unter 15 %. Bei der Entwicklung einer schweren pulmonalen Hypertonie beträgt die durchschnittliche Überlebenszeit höchstens 3 Jahre.
 [ 74 ]
[ 74 ]

