
Alle iLive-Inhalte werden medizinisch überprüft oder auf ihre Richtigkeit überprüft.
Wir haben strenge Beschaffungsrichtlinien und verlinken nur zu seriösen Medienseiten, akademischen Forschungseinrichtungen und, wenn möglich, medizinisch begutachteten Studien. Beachten Sie, dass die Zahlen in Klammern ([1], [2] usw.) anklickbare Links zu diesen Studien sind.
Wenn Sie der Meinung sind, dass einer unserer Inhalte ungenau, veraltet oder auf andere Weise bedenklich ist, wählen Sie ihn aus und drücken Sie Strg + Eingabe.
Wissenschaftler entdecken neuen immunsuppressiven Mechanismus bei Hirntumoren
Zuletzt überprüft: 02.07.2025
 ">
">Außerordentlicher Professor Filippo Veglia, Ph.D., und sein Team am Wistar Institute haben einen Schlüsselmechanismus entdeckt, durch den das Glioblastom – ein schwerer und oft tödlicher Hirntumor – das Immunsystem unterdrückt, sodass der Tumor ungehindert von der körpereigenen Abwehr wachsen kann.
Ihre Entdeckung wurde in dem Artikel „Glucose-driven histone lactylation promotes the immunosuppressive activity of monocyte-derived macrophages in glioblastoma“ in der Zeitschrift Immunity veröffentlicht.
„Unsere Studie zeigt, dass die Selbsterhaltungsmechanismen des Krebses, sofern sie ausreichend verstanden werden, sehr effektiv gegen die Krankheit eingesetzt werden können“, sagte Dr. Veglia.
„Ich freue mich auf zukünftige Studien zu stoffwechselvermittelten Immunsuppressionsmechanismen beim Glioblastom und hoffe, dass wir weiterhin mehr darüber erfahren, wie wir diesen Krebs besser verstehen und bekämpfen können.“
Bislang ist wenig darüber bekannt, wie aus Monozyten stammende Makrophagen und Mikroglia beim Glioblastom ein immunsuppressives Tumormikroumfeld schaffen.
Das Veglia-Labor untersuchte die zellulären Mechanismen der Immunsuppression bei Glioblastomen und fand heraus, dass mit Fortschreiten des Glioblastoms die Zahl der aus Monozyten stammenden Makrophagen die der Mikroglia zu übertreffen beginnt. Dies legt die Vermutung nahe, dass das Vorherrschen von aus Monozyten stammenden Makrophagen in der Tumormikroumgebung dem Krebs im Hinblick auf die Immunflucht förderlich ist.
Tatsächlich blockierten aus Monozyten stammende Makrophagen, nicht jedoch Mikroglia, die Aktivität von T-Zellen (Tumorzellen abtötenden Immunzellen) in präklinischen Modellen und bei Patienten. Das Team bestätigte dies durch die Auswertung präklinischer Glioblastommodelle mit künstlich reduzierter Anzahl aus Monozyten stammender Makrophagen.
Wie erwartet zeigten Modelle mit weniger malignen Makrophagen in der Tumormikroumgebung bessere Ergebnisse als Standard-Glioblastommodelle.
Das Glioblastom macht etwas mehr als die Hälfte aller bösartigen Tumoren im Gehirn aus. Die Prognose für Patienten mit dieser Krankheit ist äußerst schlecht: Nur 25 % der Patienten überleben das erste Jahr nach der Diagnose. Das Glioblastom ist nicht nur wegen seiner Lage im Gehirn gefährlich, sondern auch wegen der immunsuppressiven Tumormikroumgebung, die das Glioblastom resistent gegen vielversprechende Immuntherapien macht.
Durch die Programmierung bestimmter Immunzellen, wie etwa Makrophagen (aus Monozyten stammende Makrophagen und Mikroglia), auf die Unterstützung des Tumors und nicht gegen ihn, schafft das Glioblastom eine Tumor-Mikroumgebung, die es dem Krebs ermöglicht, aggressiv zu wachsen und gleichzeitig der Immunreaktion gegen den Krebs zu entgehen.
Klärung des Mechanismus
Nachdem die Rolle der aus Monozyten stammenden Makrophagen bestätigt worden war, versuchte Weglias Labor anschließend, genau zu verstehen, wie diese krebsassoziierten Immunzellen gegen das Immunsystem arbeiten.
Sie sequenzierten die Makrophagen, um festzustellen, ob die Zellen abnormale Genexpressionsmuster aufwiesen, die auf Gene hinweisen könnten, die bei der Immunsuppression eine Rolle spielen. Außerdem untersuchten sie die Stoffwechselmuster der Makrophagen, um festzustellen, ob die abnormale Genexpression mit dem Stoffwechsel zusammenhängt.
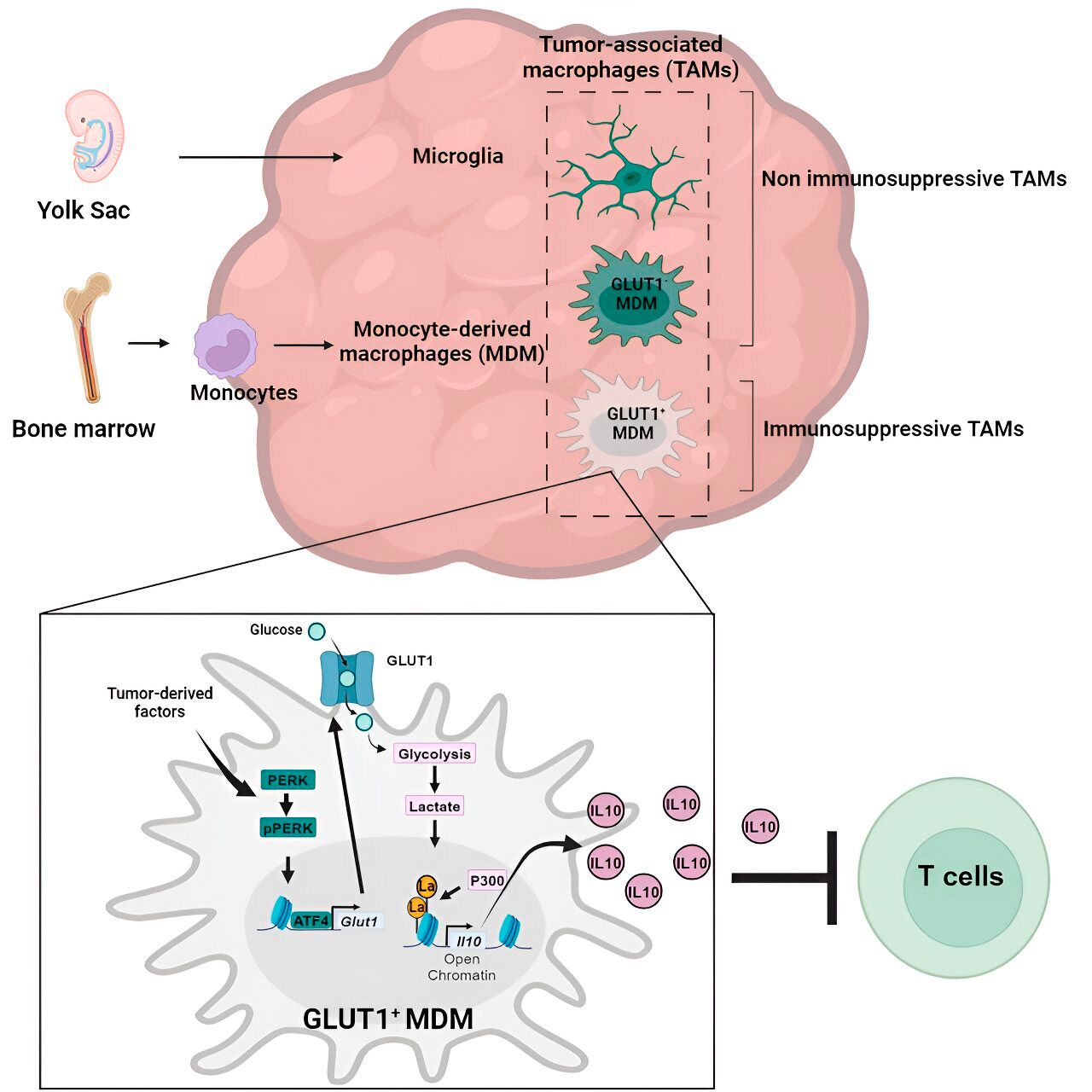
Gen- und Stoffwechselanalysen führten sie zum Glukosestoffwechsel. Eine Reihe von Tests zeigte, dass aus Monozyten stammende Makrophagen mit erhöhtem Glukosestoffwechsel und Expression von GLUT1, dem Haupttransporter für Glukose, die T-Zell-Funktion durch die Freisetzung von Interleukin-10 (IL-10) blockierten.
Das Team zeigte, dass das Glioblastom den Glukosestoffwechsel in diesen Makrophagen stört und so deren immunsuppressive Aktivität verursacht.
Histon-Lactylierung und ihre Rolle
Die Forscher fanden heraus, dass der Schlüssel zur immunsuppressiven Wirkung von aus Monozyten stammenden Makrophagen im Zusammenhang mit dem Glukosestoffwechsel in einem Prozess namens „Histon-Lactylierung“ liegt. Histone sind Strukturproteine im Genom, die in bestimmten Kontexten eine Schlüsselrolle bei der Expression von Genen wie IL-10 spielen.
Durch den schnellen Stoffwechsel von Glukose produzieren aus Monozyten stammende Makrophagen Laktat, ein Nebenprodukt des Glukosestoffwechsels. Histone können „lactyliert“ werden (d. h. Laktat wird in die Histone eingebaut), wodurch die Histonorganisation die Expression von IL-10 fördert, das von aus Monozyten stammenden Makrophagen zur Unterstützung des Krebszellwachstums produziert wird.
Lösung des Problems
Doch wie lässt sich die immunsuppressive Aktivität von aus Monozyten stammenden Makrophagen, die mit dem Glukosestoffwechsel in Zusammenhang stehen, stoppen? Dr. Veglia und sein Team fanden eine mögliche Lösung: PERK, ein Enzym, das sie als Regulator des Glukosestoffwechsels und der GLUT1-Expression in Makrophagen identifizierten.
In präklinischen Glioblastommodellen beeinträchtigte die gezielte Behandlung von PERK die Histon-Laktylierung und die immunsuppressive Aktivität der Makrophagen. In Kombination mit einer Immuntherapie blockierte sie das Fortschreiten des Glioblastoms und induzierte eine langfristige Immunität, die das Gehirn vor erneutem Tumorwachstum schützte. Dies legt nahe, dass die gezielte Behandlung der PERK-Histon-Laktylierungsachse eine praktikable Strategie zur Bekämpfung dieses tödlichen Hirntumors sein könnte.
