
Alle iLive-Inhalte werden medizinisch überprüft oder auf ihre Richtigkeit überprüft.
Wir haben strenge Beschaffungsrichtlinien und verlinken nur zu seriösen Medienseiten, akademischen Forschungseinrichtungen und, wenn möglich, medizinisch begutachteten Studien. Beachten Sie, dass die Zahlen in Klammern ([1], [2] usw.) anklickbare Links zu diesen Studien sind.
Wenn Sie der Meinung sind, dass einer unserer Inhalte ungenau, veraltet oder auf andere Weise bedenklich ist, wählen Sie ihn aus und drücken Sie Strg + Eingabe.
Endometritis
Facharzt des Artikels
Zuletzt überprüft: 04.07.2025
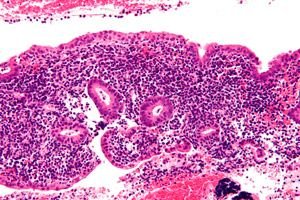
Endometritis ist eine infektiöse Entzündung der Gebärmutterschleimhaut, die bei unsachgemäßer Diagnose und Behandlung zu schweren Langzeitkomplikationen bei Frauen führen kann. Die Diagnose einer Endometritis kann schwierig sein und wird aufgrund des breiten Spektrums möglicher klinischer Symptome oft unterdiagnostiziert. Die Behandlung erfordert eine genaue und schnelle Diagnose der Erkrankung, geeignete Antibiotika und die Koordination zwischen multidisziplinären Spezialisten. [ 1 ]
Endometritis ist eine Entzündung des Endometriums, der inneren Gebärmutterschleimhaut, die meist eine infektiöse Ursache hat. [ 2 ] Eine Infektion, die sich auf die Eileiter, Eierstöcke oder das Beckenperitoneum ausbreitet, wird als Beckenentzündung (PID) bezeichnet. [ 3 ] Endometritis wird traditionell in zwei Typen unterteilt: akute und chronische. Postpartale Endometritis ist ein Subtyp der akuten Endometritis, der mit einer Schwangerschaft einhergeht. [ 4 ], [ 5 ]
Epidemiologie
Akute Endometritis
Allein die Häufigkeit einer akuten Endometritis ist eine Herausforderung, da sie häufig im Zusammenhang mit einer PID auftritt. In den USA beträgt die Häufigkeit dieser Erkrankung etwa 8 % und in Entwicklungsländern 32 %.[ 6 ] In den USA werden Fälle von PID häufig mit Infektionen mit Chlamydia trachomatis und Neisseria gonorrhoeae in Verbindung gebracht; sie machen 50 % dieser Fälle aus.[ 7 ]
Chronische Endometritis
Angesichts des meist milden Verlaufs ist die tatsächliche Prävalenz der chronischen Endometritis schwer abzuschätzen. Einige Studien haben gezeigt, dass die Inzidenz bei wiederholten Fehlgeburten bei fast 30 % liegt. Die Inzidenz variiert jedoch selbst innerhalb derselben Studie je nach Menstruationsphase, in der die Endometriumbiopsie durchgeführt wurde. [ 8 ], [ 9 ]
Postpartale Endometritis
Postpartale Endometritis ist die häufigste Ursache für Kindbettfieber in der Schwangerschaft.[ 10 ] Die Inzidenz liegt bei 1–3 % bei Patientinnen ohne Risikofaktoren nach einer normalen spontanen vaginalen Entbindung und steigt bei Vorhandensein von Risikofaktoren auf etwa 5–6 %. [Ein Kaiserschnitt ist ein bedeutender Risikofaktor, da er mit einem 5- bis 20-fach erhöhten Risiko einer postpartalen Endometritis im Vergleich zu einer spontanen vaginalen Entbindung verbunden ist. Erfolgt der Kaiserschnitt nach einem Riss der Amnionmembran, ist das Risiko sogar noch höher.[ 11 ],[ 12 ] Eine geeignete Antibiotikaprophylaxe kann das Risiko einer postpartalen Endometritis verringern. Ohne Antibiotikaprophylaxe erkranken bis zu 20 % der Patientinnen.[ 13 ] Unbehandelt kann die Sterblichkeitsrate einer postpartalen Endometritis bis zu 17 % betragen.[ 14 ]
Ursachen Endometritis
Eine Endometritis entsteht in erster Linie durch das Aufsteigen von Mikroorganismen aus dem unteren Genitaltrakt (d. h. dem Gebärmutterhals und dem Scheidengewölbe) in die Gebärmutterhöhle. Die spezifischen Erreger, die das Endometrium am häufigsten infizieren, variieren je nach Endometritistyp und sind manchmal schwer zu identifizieren.
Akute Endometritis
Bei akuter Endometritis sind mehr als 85 % der infektiösen Ätiologien auf sexuell übertragbare Infektionen (STIs) zurückzuführen. Im Gegensatz zur chronischen und postpartalen Endometritis, deren Ursache mit mehreren Mikroorganismen assoziiert ist, ist die primäre mikrobielle Ätiologie der akuten Endometritis Chlamydia trachomatis, gefolgt von Neisseria gonorrhoeae und BV-assoziierten Bakterien.[ 15 ]
Zu den Risikofaktoren für eine akute Endometritis zählen ein Alter unter 25 Jahren, sexuell übertragbare Krankheiten in der Vorgeschichte, riskantes Sexualverhalten (z. B. mehrere Partner) und gynäkologische Eingriffe wie Intrauterinpessare oder Endometriumbiopsien. Diese Faktoren tragen bei manchen Menschen zu einer erhöhten Anfälligkeit für die Erkrankung bei.[ 16 ]
Chronische Endometritis
Die Ätiologie der chronischen Endometritis ist oft unbekannt. Einige Studien haben eine mögliche Endometriumentzündung mit nichtinfektiösen Ursachen (z. B. Intrauterinpessare, Endometriumpolypen, submuköse Leiomyome) nachgewiesen. Wird der Erreger jedoch identifiziert, handelt es sich häufig um eine polymikrobielle Infektion mit Erregern, die häufig im Scheidengewölbe vorkommen. Darüber hinaus kann Genitaltuberkulose zu einer chronischen granulomatösen Endometritis führen, die vor allem in Entwicklungsländern auftritt.[5] Im Gegensatz zur akuten Endometritis sind Chlamydia trachomatis und Neisseria gonorrhoeae nicht die häufigsten Ursachen.[5] Zu den wichtigsten identifizierten Erregern gehören:
- Streptokokken
- Enterococcus fecalis
- E. coli
- Klebsiella-Pneumonie
- Staphylokokken
- Mykoplasmen
- Ureaplasma
- Gardnerella vaginalis
- Pseudomonas aeruginosa
- Saccharomyces cerevisiae und Candida-Arten [ 17 ]
Chronische Endometritis ist mit verschiedenen Risikofaktoren verbunden, darunter die Verwendung von Intrauterinpessaren, Mehrlingsschwangerschaften in der Vorgeschichte, frühere Schwangerschaftsabbrüche und anormale Gebärmutterblutungen. Diese Faktoren sind wichtige Überlegungen zum Verständnis der möglichen Ursachen und Faktoren, die zu chronischer Endometritis beitragen.
Postpartale Endometritis
Während der Schwangerschaft schützt die Fruchtblase die Gebärmutterhöhle vor Infektionen, und eine Endometritis ist selten. Mit der Erweiterung des Gebärmutterhalses und dem Platzen der Membranen steigt das Risiko einer Besiedlung der Gebärmutterhöhle durch Mikroorganismen aus dem Scheidengewölbe. Dieses Risiko wird durch den Einsatz von Instrumenten und das Einbringen von Fremdkörpern in die Gebärmutterhöhle zusätzlich erhöht. Bakterien besiedeln zudem häufiger devitalisiertes oder anderweitig geschädigtes Gebärmuttergewebe. [ 18 ] Wie intraamniotische Infektionen ist auch die postpartale Endometriuminfektion polymikrobiell und betrifft sowohl aerobe als auch anaerobe Bakterien, darunter:
- Grampositive Kokken: Treptokokken der Gruppen A und B, Staphylokokken, Enterokokken.
- Gramnegative Stäbchen: Escherichia coli, Klebsiella pneumoniae, Proteus.
- Anaerobe Mikroorganismen: Bacteroides, Peptostreptococcus, Peptococcus, Prevotella und Clostridium.
- Sonstige: Mycoplasma, Neisseria gonorrhoeae [ 19 ],
Chlamydia trachomatis ist eine seltene Ursache einer postpartalen Endometritis, wird jedoch häufig mit einem späten Krankheitsbeginn in Verbindung gebracht.[ 20 ] Obwohl selten, sind schwere Infektionen mit Streptococcus pyogenes, Staphylococcus aureus, Clostridium sordellii oder Clostridium perfringens mit einer erhöhten Morbidität und Mortalität verbunden.[ 21 ]
Postpartale Endometritis ist mit mehreren Risikofaktoren verbunden, darunter Kaiserschnitt, intrapartale intraamniotische Infektion (bekannt als Chorioamnionitis), verlängerter Blasensprung oder verlängerte Wehen, Fremdkörper in der Gebärmutter (z. B. mehrfache Gebärmutterhalsuntersuchungen und invasive fetale Überwachungsgeräte), manuelle Entfernung der Plazenta, operative vaginale Entbindung und bestimmte mütterliche Faktoren wie HIV-Infektion, Diabetes mellitus und Übergewicht. Das Erkennen dieser Risikofaktoren ist entscheidend für die Diagnose und Behandlung einer postpartalen Endometritis, da sie zur Entwicklung dieser Erkrankung beitragen und präventive Maßnahmen und Behandlungsstrategien leiten können.[ 22 ]
Pathogenese
Akute Endometritis entsteht durch eine aufsteigende Infektion des Gebärmutterhalses und des Scheidengewölbes, die meist durch Chlamydia trachomatis verursacht wird. Endozervikale Infektionen stören die Barrierefunktion des Gebärmutterhalskanals und ermöglichen so ein Aufsteigen der Infektion.
Im Gegensatz dazu ist die chronische Endometritis durch eine Infektion des Endometriums mit Mikroorganismen gekennzeichnet, die nicht unbedingt mit einer gleichzeitigen Besiedlung des Gebärmutterhalses oder der Vagina einhergehen. Die mikrobielle Infektion führt zu einer Immunreaktion und chronischen Entzündung mit signifikanten Infiltraten endometrialer Stromaplasmazellen und der Entwicklung von Mikropolypen.[ 23 ] Es kommt außerdem zu einem Anstieg von Interleukin-1b und Tumornekrosefaktor-Alpha, was die Östrogensynthese in endometrialen Drüsenzellen steigert. Diese erhöhte Östrogensynthese kann mit Mikropolypen einhergehen, die bei Patientinnen mit chronischer Endometritis häufig bei hysteroskopischen Untersuchungen beobachtet werden.
Bei einer postpartalen Endometritis kann durch den Blasensprung Bakterienflora aus Gebärmutterhals und Vagina in die Gebärmutterschleimhaut eindringen.[4] Diese Bakterien besiedeln eher devitalisiertes, blutendes oder anderweitig geschädigtes Gebärmuttergewebe (z. B. bei einem Kaiserschnitt). Sie können auch in das Myometrium eindringen und dort Entzündungen und Infektionen verursachen.
Symptome Endometritis
Die klinische Diagnose einer akuten und postpartalen Endometritis basiert auf charakteristischen Symptomen und Untersuchungsbefunden; eine chronische Endometritis verläuft oft asymptomatisch und erfordert in der Regel eine histologische Bestätigung. Klinische Anamnese und Symptome können sich bei den verschiedenen Endometritisarten und Differenzialdiagnosen überschneiden; einige klinische Merkmale sind jedoch eher mit einer Endometritisart assoziiert als mit anderen. Daher ist eine gründliche Anamnese für eine genaue Diagnose unerlässlich. Ärzte, die die Anamnese erheben, sollten auch versuchen, häufige Risikofaktoren für eine PID (z. B. mehrere Sexualpartner, sexuell übertragbare Infektionen in der Anamnese) und Hinweise auf eine Differenzialdiagnose basierend auf einer gründlichen geburtshilflichen und sexuellen Anamnese zu identifizieren.
Akute Endometritis
Zu den typischen Symptomen einer akuten Endometritis gehören plötzlich auftretende Beckenschmerzen, Dyspareunie und vaginaler Ausfluss, die am häufigsten bei sexuell aktiven Personen auftreten, obwohl die Patientinnen auch asymptomatisch sein können. Je nach Schwere der Erkrankung können auch systemische Symptome wie Fieber und Unwohlsein auftreten, die in leichteren Fällen jedoch oft fehlen. Weitere Symptome sind abnorme Gebärmutterblutungen (z. B. postkoitale, intermenstruelle oder starke Menstruationsblutungen), Dyspareunie und Dysurie.[ 24 ] Bei Patientinnen mit PID können Symptome infolge einer Perihepatitis (z. B. Fitz-Hugh-Curtis-Syndrom), eines Tuboovarialabszesses oder einer Salpingitis auftreten, darunter Schmerzen im rechten Oberbauch und Unterleibsschmerzen.
Chronische Endometritis
Patientinnen mit chronischer Endometritis haben häufig wiederholte Fehlgeburten, wiederholte Implantationsfehler und Unfruchtbarkeit. Chronische Endometritis verläuft oft asymptomatisch. Wenn Symptome auftreten, sind diese meist unspezifisch; abnorme Gebärmutterblutungen, Beckenbeschwerden und Weißfluss sind die häufigsten Beschwerden.
Postpartale Endometritis
Das wichtigste klinische Merkmal einer postpartalen Endometritis ist Fieber nach einer kürzlich erfolgten Geburt oder Fehlgeburt. Frühe Symptome treten innerhalb von 48 Stunden nach der Geburt auf, späte bis zu sechs Wochen nach der Geburt. Zu den Symptomen, die die Diagnose unterstützen, gehören Druckempfindlichkeit der Gebärmutter, starke Unterleibsschmerzen, übelriechender eitriger Wochenfluss und eine Subinvolution der Gebärmutter.[22] Allgemeine Symptome wie Unwohlsein, Kopfschmerzen und Schüttelfrost können ebenfalls auftreten.
Komplikationen und Konsequenzen
Akute Endometritis, insbesondere in Verbindung mit einer PID, kann zu Unfruchtbarkeit, chronischen Beckenschmerzen und einer Eileiterschwangerschaft führen. Zusätzlich kann sich aus einer aufsteigenden Infektion ein tubo-ovarieller Abszess entwickeln.[ 25 ] Zu den Komplikationen einer chronischen Endometritis gehören Fruchtbarkeitsprobleme (z. B. wiederholte Fehlgeburten und Implantationsversagen) sowie abnorme Gebärmutterblutungen. Bei etwa 1 bis 4 % der Patientinnen mit postpartaler Endometritis können Komplikationen wie Sepsis, Abszesse, Hämatome, septische Beckenthrombophlebitis und nekrotisierende Fasziitis auftreten. Eine Operation kann erforderlich sein, wenn die Infektion zu einer Ansammlung von abfließender Flüssigkeit geführt hat.
Diagnose Endometritis
Die Studien 1, 2, 3, 5 werden bei allen Patienten durchgeführt, 4, 6 – wenn technisch möglich und wenn Zweifel an der Diagnose bestehen.
- Thermometrie. Bei leichter Form steigt die Körpertemperatur auf 38–38,5 °C, bei schwerer Form liegt die Temperatur über 39 °C.
- Klinische Blutuntersuchung. Bei leichter Form beträgt die Leukozytenzahl 9–12 × 10 9 /l, es wird eine leichte Linksverschiebung der Neutrophilen in der Leukozytenzahl festgestellt; die BSG beträgt 30–55 mm/h. Bei schwerer Form erreicht die Leukozytenzahl 10–30 × 10 9 /l, es wird eine Linksverschiebung der Neutrophilen und eine toxische Granularität der Leukozyten festgestellt; die BSG beträgt 55–65 mm/h.
- Ultraschall der Gebärmutter. Er wird bei allen Frauen in den Wehen nach spontaner Geburt oder Kaiserschnitt am 3.-5. Tag durchgeführt. Das Volumen der Gebärmutter und ihre anterior-posteriore Größe werden vergrößert. Ein dichter fibrinöser Belag an den Gebärmutterwänden, das Vorhandensein von Gas in der Gebärmutterhöhle und im Bereich der Ligaturen werden festgestellt.
- Hysteroskopie. Es gibt 3 Varianten der Endometritis je nach Grad der Vergiftung des Körpers und lokalen Manifestationen:
- Endometritis (weißlicher Belag an den Gebärmutterwänden aufgrund einer fibrinösen Entzündung);
- Endometritis mit Nekrose des Dezidualgewebes (Endometriumstrukturen sind schwarz, faserig und ragen leicht über die Gebärmutterwand hinaus);
- Endometritis mit Retention von Plazentagewebe, häufiger nach der Geburt (eine klumpige Struktur mit bläulicher Tönung hebt sich scharf vom Hintergrund der Gebärmutterwände ab).
Bei einer Reihe von Patientinnen wird ein Gewebedefekt in Form einer Nische oder eines Durchgangs diagnostiziert – ein Zeichen für eine teilweise Divergenz der Nähte an der Gebärmutter.
- Bakteriologische Untersuchung des Aspirats aus der Gebärmutterhöhle mit Bestimmung der Antibiotikaempfindlichkeit. Nichtsporenbildende Anaerobier (82,7 %) und ihre Assoziationen mit aeroben Mikroorganismen überwiegen. Die anaerobe Flora reagiert hochempfindlich auf Metronidazol, Clindamycin und Lincomycin, die aerobe Flora auf Ampicillin, Carbenicillin, Gentamicin und Cephalosporine.
- Bestimmung des Säure-Basen-Haushalts des Wochenflusses. Eine Endometritis ist gekennzeichnet durch einen pH-Wert < 7,0, einen pCO₂-Wert > 50 mmHg und einen pO₂-Wert < 30 mmHg. Veränderungen dieser Parameter gehen klinischen Manifestationen der Erkrankung voraus.
Screening
Um Frauen in den Wehen mit einer Subinvolution der Gebärmutter zu identifizieren, bei denen das Risiko einer postpartalen Endometritis besteht, wird am 3.–5. Tag nach der Entbindung eine Ultraschalluntersuchung durchgeführt.
Was muss untersucht werden?
Differenzialdiagnose
Neben einer akuten Endometritis umfasst die Differentialdiagnose von Beckenschmerzen eine Eileiterschwangerschaft, eine hämorrhagische oder rupturierte Ovarialzyste, eine Ovarialtorsion, Endometriose, einen tubo-ovariellen Abszess, eine akute Zystitis, Nierensteine und gastrointestinale Ursachen (z. B. Blinddarmentzündung, Divertikulitis, Reizdarmsyndrom).
Häufige Symptome einer chronischen Endometritis sind häufig abnorme Gebärmutterblutungen (AUB) oder Fruchtbarkeitsprobleme. Die Differentialdiagnose unregelmäßiger Blutungen ist breit gefächert. Das American College of Obstetricians and Gynecologists (ACOG) empfiehlt die Klassifizierung abnormer Gebärmutterblutungen nach dem PALM-COEIN-System. Dieses Akronym steht für Polypen, Adenomyose, Leiomyome, maligne Erkrankungen, Koagulopathie, Ovulationsstörungen, endometriale Ursachen (z. B. akute oder chronische Endometritis), iatrogene Ursachen (z. B. Antikoagulanzien, hormonelle Kontrazeptiva) und noch nicht klassifizierte Ursachen. [ 26 ] Auch bei Unfruchtbarkeit gibt es ein breites Differenzial, das uterine Faktoren, Tubenfaktoren, ovulatorische oder hormonelle Störungen, Chromosomenprobleme und männliche Faktoren umfasst. [ 27 ]
Bei Patienten mit Kindbettfieber umfasst die Differentialdiagnose eine Wundinfektion, eine Harnwegsinfektion, eine Pyelonephritis, eine Mastitis, eine Lungenentzündung, eine Sepsis, eine Peritonitis und eine septische Beckenthrombophlebitis.
Wen kann ich kontaktieren?
Behandlung Endometritis
Ziel der Endometritis-Behandlung ist die Entfernung des Erregers, die Linderung der Krankheitssymptome, die Normalisierung von Laborwerten und Funktionsstörungen sowie die Vorbeugung von Krankheitskomplikationen.
Akute Endometritis
Die CDC empfiehlt mehrere verschiedene Antibiotika-Therapieschemata.[ 28 ],[ 29 ] Die folgenden oralen Therapieschemata werden für leichte bis mittelschwere Fälle empfohlen, die ambulant behandelt werden können.
- Option 1:
- Ceftriaxon 500 mg einmal intramuskulär.
- + Doxycyclin 100 mg oral zweimal täglich für 14 Tage.
- + Metronidazol 500 mg oral zweimal täglich für 14 Tage
- Option 2:
- Cefoxitin 2 g intramuskulär einmal mit Probenecid 1 g oral einmal
- + Doxycyclin 100 mg oral zweimal täglich für 14 Tage.
- + Metronidazol 500 mg oral zweimal täglich für 14 Tage
- Option 3:
- Andere parenterale Cephalosporine der dritten Generation (z. B. Ceftizoxim oder Cefotaxim)
- + Doxycyclin 100 mg oral zweimal täglich für 14 Tage.
- + Metronidazol 500 mg oral zweimal täglich für 14 Tage
- Alternative Behandlungsschemata für Patienten mit schwerer Cephalosporinallergie umfassen:
- Levofloxacin 500 mg oral einmal täglich oder Moxifloxacin 400 mg oral einmal täglich (bevorzugt bei M. genitalium-Infektionen) für 14 Tage
- + Metronidazol 500 mg alle 8 Stunden für 14 Tage
- Azithromycin 500 mg i.v. einmal täglich für 1–2 Dosen, dann 250 mg oral täglich + Metronidazol 500 mg oral zweimal täglich für 12–14 Tage [28]
Indikationen für eine stationäre Aufnahme sind:
- Tuboovarianer Abszess
- Versagen der ambulanten Behandlung oder Unfähigkeit, die ambulante Behandlung einzuhalten oder zu tolerieren
- Schwere Erkrankung, Übelkeit, Erbrechen oder orale Temperatur >101°F (38,5°C)
- Die Notwendigkeit eines operativen Eingriffs (z. B. bei einer Blinddarmentzündung) kann nicht ausgeschlossen werden .
Stationäre parenterale Antibiotika werden verabreicht, bis die Patienten Anzeichen einer klinischen Besserung zeigen (z. B. Fiebersenkung und Abdominalschmerz), in der Regel für 24 bis 48 Stunden. Danach kann auf eine orale Therapie umgestellt werden. Empfohlene parenterale Therapien umfassen:
- Cefoxitin 2 g intravenös alle 6 Stunden oder Cefotetan 2 g intravenös alle 12 Stunden.
- + Doxycyclin 100 mg oral oder intravenös alle 12 Stunden
Alternative parenterale Therapien:
- Ampicillin-Sulbactam 3 g i.v. alle 6 Stunden + Doxycyclin 100 mg oral oder i.v. alle 12 Stunden
- Clindamycin 900 mg i.v. alle 8 Stunden + Gentamicin i.v. oder i.m. 3-5 mg/kg alle 24 Stunden
Chronische Endometritis
Chronische Endometritis wird üblicherweise mit Doxycyclin 100 mg oral zweimal täglich über 14 Tage behandelt. Bei Patientinnen, bei denen die Doxycyclin-Therapie versagt, können Metronidazol 500 mg oral täglich über 14 Tage und Ciprofloxacin 400 mg oral täglich über 14 Tage angewendet werden.
Bei chronischer granulomatöser Endometritis wird eine Tuberkulosetherapie empfohlen, die Folgendes umfasst:
- Isoniazid 300 mg pro Tag
- + Rifampicin 450–600 mg pro Tag
- + Ethambutol von 800 bis 1200 mg pro Tag
- + Pyrazinamid 1200-1500 mg pro Tag
Postpartale Endometritis
Die meisten Patientinnen sollten intravenös Antibiotika erhalten, darunter auch Patientinnen mit mittelschwerer bis schwerer Erkrankung, Verdacht auf Sepsis oder Endometritis nach Kaiserschnitt. Ein Cochrane-Review zu Antibiotika-Therapien bei postpartaler Endometritis ergab, dass die folgenden Therapien mit Clindamycin und Gentamicin am wirksamsten sind:
- Gentamicin 5 mg/kg i.v. alle 24 Stunden (bevorzugt) oder 1,5 mg/kg i.v. alle 8 Stunden oder + Clindamycin 900 mg i.v. alle 8 Stunden
- Wenn der Test auf Streptokokken der Gruppe B positiv ist oder sich die Anzeichen und Symptome nicht innerhalb von 48 Stunden bessern, fügen Sie Folgendes hinzu:
- Ampicillin 2 g intravenös alle 6 Stunden oder
- Ampicillin 2 g intravenös als Aufsättigungsdosis, dann 1 g alle 4–8 Stunden.
- Ampicillin-Sulbactam 3 g intravenös alle 6 Stunden
Bei Patienten, die sich innerhalb von 72 Stunden nicht bessern, sollten Ärzte die Differenzialdiagnose um andere Infektionen wie Lungenentzündung, Pyelonephritis und septische Thrombophlebitis des Beckens erweitern. Die intravenöse Antibiotikagabe sollte so lange fortgesetzt werden, bis die Patientin mindestens 24 Stunden fieberfrei bleibt, neben der Schmerzlinderung und der Rückbildung der Leukozytose. Es gibt keine stichhaltigen Belege dafür, dass die Fortsetzung der oralen Antibiotikagabe nach klinischer Besserung den patientenbezogenen Behandlungserfolg signifikant verbessert. [ 30 ] Bei Patientinnen mit leichten Symptomen, die nach der Entlassung aus dem Krankenhaus festgestellt werden (z. B. spät einsetzende postpartale Endometritis), kann eine orale Antibiotikatherapie sorgfältig erwogen werden.
Prognose
Unbehandelt liegt die Sterblichkeitsrate bei postpartaler Endometritis bei etwa 17 %. In Industrieländern ist die Prognose bei entsprechender Behandlung jedoch meist ausgezeichnet. Auch die akute Endometritis selbst hat eine ausgezeichnete Prognose, geht jedoch häufig mit einer Salpingitis einher, die das Risiko einer Eileiterunfruchtbarkeit deutlich erhöht. Es gibt Hinweise darauf, dass sich die Fruchtbarkeit nach der Behandlung einer chronischen Endometritis deutlich verbessern kann. So war beispielsweise in einer Studie mit Embryotransferzyklen am dritten Tag die Lebendgeburtenrate bei behandelten Patientinnen im Vergleich zu unbehandelten Patientinnen signifikant höher (ca. 60–65 % versus 6–15 %). Eine andere Studie ergab, dass bei Patientinnen mit wiederholten Fehlgeburten und chronischer Endometritis die Lebendgeburtenrate von 7 % vor der Behandlung auf 56 % nach der Behandlung anstieg.[ 31 ]

