
Alle iLive-Inhalte werden medizinisch überprüft oder auf ihre Richtigkeit überprüft.
Wir haben strenge Beschaffungsrichtlinien und verlinken nur zu seriösen Medienseiten, akademischen Forschungseinrichtungen und, wenn möglich, medizinisch begutachteten Studien. Beachten Sie, dass die Zahlen in Klammern ([1], [2] usw.) anklickbare Links zu diesen Studien sind.
Wenn Sie der Meinung sind, dass einer unserer Inhalte ungenau, veraltet oder auf andere Weise bedenklich ist, wählen Sie ihn aus und drücken Sie Strg + Eingabe.
Nebenschilddrüsen
Facharzt des Artikels
Zuletzt überprüft: 04.07.2025

1879 beschrieb der schwedische Wissenschaftler S. Sandstrom die Nebenschilddrüsen des Menschen und gab ihnen einen Namen. Die Nebenschilddrüsen sind lebenswichtige Organe. Ihre Funktion ist die Produktion und Sekretion des Parathormons (PTH), einem der Hauptregulatoren des Kalzium- und Phosphorstoffwechsels.
Die paarige obere Nebenschilddrüse (Glandula parathyroidea superior) und die untere Nebenschilddrüse (Glandula parathyroidea inferior) sind runde oder eiförmige Körper, die sich auf der Rückseite jedes Schilddrüsenlappens befinden: eine Drüse oben, die andere unten. Die Länge jeder Drüse beträgt 4–8 mm, die Breite 3–4 mm und die Dicke 2–3 mm. Die Anzahl dieser Drüsen ist nicht konstant und kann zwischen 2 und 7–8 variieren; im Durchschnitt sind es vier. Die Gesamtmasse der Drüsen beträgt durchschnittlich 1,18 g.
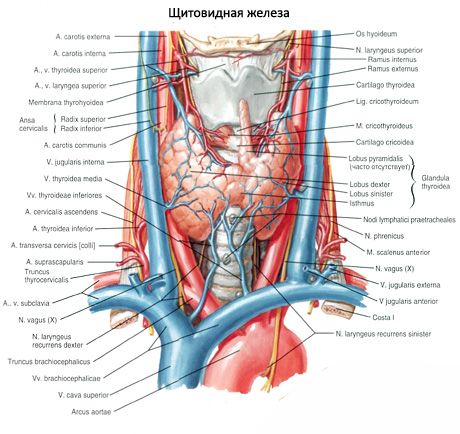
Die Nebenschilddrüsen unterscheiden sich von der Schilddrüse durch ihre hellere Farbe (bei Kindern sind sie blassrosa, bei Erwachsenen gelblich-braun). Häufig befinden sich die Nebenschilddrüsen an der Stelle, an der die unteren Schilddrüsenarterien oder deren Äste in das Schilddrüsengewebe eindringen. Die Nebenschilddrüsen sind durch eine eigene Faserkapsel vom umgebenden Gewebe getrennt, von der aus Bindegewebsschichten in die Drüsen hineinragen. Letztere enthalten eine große Anzahl von Blutgefäßen und unterteilen die Nebenschilddrüsen in Gruppen von Epithelzellen.
Das Drüsenparenchym wird von den Haupt- und acidophilen Nebenschilddrüsenzellen gebildet, die Stränge und Cluster bilden, die von dünnen Bündeln von Bindegewebsfasern umgeben sind. Beide Zelltypen gelten als unterschiedliche Stadien der Nebenschilddrüsenentwicklung. Die Hauptnebenschilddrüsenzellen haben eine polyedrische Form, ein basophiles Zytoplasma mit einer großen Anzahl von Ribosomen. Unter diesen Zellen werden dunkle (aktiv sezernierende) und helle (weniger aktive) Zellen unterschieden. Acidophile Nebenschilddrüsenzellen sind groß, haben klare Konturen und enthalten viele kleine Mitochondrien mit Glykogenpartikeln.
Das Hormon der Nebenschilddrüsen, Parathyroxin (Nebenschilddrüsenhormon), ist proteinhaltig und an der Regulierung des Phosphor-Kalzium-Stoffwechsels beteiligt. Nebenschilddrüsenhormon reduziert die Kalziumausscheidung im Urin und erhöht in Gegenwart von Vitamin D dessen Aufnahme im Darm. Thyrocalcitonin ist ein Antagonist des Nebenschilddrüsenhormons.
Embryogenese der Nebenschilddrüsen
Die Nebenschilddrüsen entwickeln sich aus dem Epithel der paarigen Kiementaschen III und IV. In der 7. Entwicklungswoche lösen sich die Epithelanlagen der Körper von den Wänden der Kiementaschen und bewegen sich während des Wachstums nach kaudal. Anschließend nehmen die sich bildenden Nebenschilddrüsen eine für sie feste Position auf den hinteren Flächen des rechten und linken Schilddrüsenlappens ein.
 [ 7 ], [ 8 ], [ 9 ], [ 10 ], [ 11 ], [ 12 ]
[ 7 ], [ 8 ], [ 9 ], [ 10 ], [ 11 ], [ 12 ]
Gefäße und Nerven der Nebenschilddrüsen
Die Blutversorgung der Nebenschilddrüsen erfolgt über Äste der oberen und unteren Schilddrüsenarterien sowie über die Äste der Speiseröhre und der Luftröhre. Venöses Blut fließt durch die gleichnamigen Venen ab. Die Innervation der Nebenschilddrüsen ähnelt der der Schilddrüse.
Altersbedingte Merkmale der Nebenschilddrüsen
Die Gesamtmasse der Nebenschilddrüsen eines Neugeborenen schwankt zwischen 6 und 9 mg. Im ersten Lebensjahr nimmt ihre Gesamtmasse um das 3- bis 4-fache zu, im Alter von 5 Jahren verdoppelt sie sich erneut und im Alter von 10 Jahren verdreifacht sie sich. Nach 20 Jahren erreicht die Gesamtmasse der vier Nebenschilddrüsen 120-140 mg und bleibt bis ins hohe Alter konstant. In jedem Alter ist die Masse der Nebenschilddrüsen bei Frauen etwas größer als bei Männern.
Normalerweise hat ein Mensch zwei Paare Nebenschilddrüsen (ein oberes und ein unteres), die sich auf der Rückseite der Schilddrüse, außerhalb ihrer Kapsel, in der Nähe des oberen und unteren Pols befinden. Anzahl und Lage der Nebenschilddrüsen können jedoch variieren, manchmal findet man bis zu 12 Nebenschilddrüsen. Sie können sich im Gewebe der Schilddrüse und der Thymusdrüse, im vorderen und hinteren Mediastinum, im Herzbeutel, hinter der Speiseröhre sowie im Bereich der Gabelung der Halsschlagader befinden. Die oberen Nebenschilddrüsen haben die Form eines abgeflachten Eioids, die unteren sind kugelförmig. Ihre Abmessungen betragen ungefähr 6 x 3 bis 4 x 1,5 – 3 mm, das Gesamtgewicht beträgt 0,05 bis 0,5 g, die Farbe ist rötlich oder gelblich-braun. Die Blutversorgung der Nebenschilddrüsen erfolgt hauptsächlich über die Äste der Arteria thyreoidea inferior, der venöse Abfluss erfolgt über die Venen der Schilddrüse, der Speiseröhre und der Luftröhre. Die Nebenschilddrüsen werden durch sympathische Fasern des Nervus laryngeus recurrens und des Nervus laryngeus superior innerviert, die parasympathische Innervation erfolgt über die Vagusnerven. Die Nebenschilddrüsen sind mit einer dünnen Bindegewebskapsel umhüllt; die davon ausgehenden Septen dringen in die Drüsen ein. Sie enthalten Blutgefäße und Nervenfasern. Das Parenchym der Nebenschilddrüsen besteht aus Parathyrozyten oder Hauptzellen, unter denen je nach Färbungsgrad hormonell aktive helle oder glänzende Zellen sowie ruhende dunkle Zellen unterschieden werden. Die Hauptzellen bilden Cluster, Stränge und Cluster und bei älteren Menschen Follikel mit Kolloid in der Höhle. Bei Erwachsenen treten Zellen auf, die sich hauptsächlich entlang der Peripherie der Nebenschilddrüsen befinden und mit Eosin gefärbt sind – eosinophile oder oxyphile Zellen, die degenerierende Hauptzellen sind. In den Nebenschilddrüsen finden sich auch Übergangsformen zwischen den Haupt- und oxyphilen Zellen.
Die ersten Erfolge bei der Aufklärung der Synthesefragen, der Entschlüsselung der Struktur und der Untersuchung des Stoffwechsels des Parathormons wurden nach 1972 erzielt. Das Parathormon ist ein einkettiges Polypeptid aus 84 Aminosäureresten ohne Cystein mit einem Molekulargewicht von etwa 9500 Dalton, das in den Nebenschilddrüsen aus einem Biovorläufer, dem Proparathormon (proPTH), gebildet wird, das am NH 2 -Ende 6 zusätzliche Aminosäuren aufweist. ProPTH wird in den Hauptzellen der Nebenschilddrüsen (in ihrem granulären endoplasmatischen Retikulum) synthetisiert und bei der proteolytischen Spaltung im Golgi-Apparat in Parathormon umgewandelt. Seine biologische Aktivität ist deutlich geringer als die von PTH. Anscheinend fehlt proPTH im Blut gesunder Menschen, aber unter pathologischen Bedingungen (mit Adenomen der Nebenschilddrüsen) kann es zusammen mit PTH ins Blut ausgeschieden werden. Kürzlich wurde ein Vorläufer von proPTH, PräproPTH, entdeckt, der am NH2-Terminus zusätzliche 25 Aminosäurereste enthält. Somit enthält PräproPTH 115 Aminosäurereste, proPTH 90 und PTH 84.
Die Struktur des Parathormons von Rindern und Schweinen ist inzwischen vollständig geklärt. Menschliches Parathormon wurde aus Nebenschilddrüsenadenomen isoliert, seine Struktur ist jedoch nur teilweise entschlüsselt. Es gibt Unterschiede in der Struktur des Parathormons, aber tierische und menschliche Parathormone zeigen Kreuzimmunreaktivität. Das aus den ersten 34 Aminosäureresten bestehende Polypeptid behält praktisch die biologische Aktivität des natürlichen Hormons. Dies lässt vermuten, dass die verbleibenden fast % des Moleküls am Carboxylende nicht direkt mit den Hauptwirkungen des Parathormons zusammenhängen. Die Fragmente 1-29 des Parathormons zeigen ebenfalls eine gewisse biologische und immunologische Aktivität. Das biologisch inaktive Fragment 53-84 zeigt ebenfalls eine immunologische Wirkung, d. h. diese Eigenschaften des Parathormons weisen mindestens zwei Abschnitte seines Moleküls auf.
Das im Blut zirkulierende Parathormon ist heterogen und unterscheidet sich vom natürlichen Hormon, das von den Nebenschilddrüsen ausgeschüttet wird. Im Blut werden mindestens drei verschiedene Arten von Parathormon unterschieden: intaktes Parathormon mit einem Molekulargewicht von 9.500 Dalton; biologisch inaktive Substanzen aus dem Carboxylteil des Parathormonmoleküls mit einem Molekulargewicht von 7.000–7.500 Dalton; biologisch aktive Substanzen mit einem Molekulargewicht von etwa 4.000 Dalton.
Im venösen Blut wurden sogar noch kleinere Fragmente gefunden, was darauf hindeutet, dass sie in der Peripherie gebildet wurden. Die wichtigsten Organe, in denen Parathormonfragmente gebildet wurden, waren Leber und Nieren. Die Fragmentierung von Parathormon in diesen Organen war bei Lebererkrankungen und chronischer Niereninsuffizienz (CRF) erhöht. Unter diesen Bedingungen blieben Parathormonfragmente deutlich länger im Blutkreislauf als bei gesunden Personen. Die Leber absorbierte hauptsächlich intaktes Parathormon, entfernte jedoch weder carboxylterminale noch aminoterminale Parathormonfragmente aus dem Blut. Die Nieren spielten eine führende Rolle im Parathormonstoffwechsel. Auf sie entfielen fast 60 % der metabolischen Clearance des carboxylterminalen immunreaktiven Hormons und 45 % des aminoterminalen Fragments des Parathormons. Das aktive aminoterminale Fragment des Parathormons wurde hauptsächlich in den Knochen verstoffwechselt.
Es wurde eine pulsierende Sekretion des Parathormons festgestellt, die nachts am stärksten ausgeprägt ist. 3-4 Stunden nach Beginn des Nachtschlafs ist sein Gehalt im Blut 2,5-3 mal höher als der durchschnittliche Tageswert.
Die Hauptfunktion des Parathormons ist die Aufrechterhaltung der Kalziumhomöostase. Gleichzeitig ist Serumkalzium (gesamt und insbesondere ionisiert) der Hauptregulator der Parathormonsekretion (ein Abfall des Kalziumspiegels stimuliert die Parathormonsekretion, ein Anstieg unterdrückt sie), d. h. die Regulierung erfolgt nach dem Rückkopplungsprinzip. Bei Hypokalzämie erhöht sich die Umwandlung von ProPTH in Parathormon. Auch der Magnesiumgehalt im Blut spielt eine wichtige Rolle bei der Freisetzung von Parathormon (ein erhöhter Spiegel stimuliert, ein erniedrigter unterdrückt die Parathormonsekretion). Die Hauptangriffspunkte des Parathormons sind die Nieren und die Skelettknochen, aber die Wirkung des Parathormons auf die Kalziumaufnahme im Darm, die Kohlenhydrattoleranz, den Serumlipidspiegel, seine Rolle bei der Entstehung von Impotenz, Hautjucken usw. ist bekannt.
Um die Wirkung des Parathormons auf die Knochen zu charakterisieren, ist es notwendig, kurze Informationen über die Struktur des Knochengewebes sowie die Merkmale seiner physiologischen Resorption und Umgestaltung bereitzustellen.
Es ist bekannt, dass der größte Teil des Kalziums im Körper (bis zu 99 %) im Knochengewebe enthalten ist. Da es im Knochen in Form von Phosphor-Kalzium-Verbindungen vorkommt, befinden sich auch % des gesamten Phosphorgehalts in den Knochen. Ihr Gewebe wird trotz seiner scheinbar statischen Natur ständig umgebaut, aktiv vaskularisiert und weist hohe mechanische Eigenschaften auf. Knochen ist ein dynamisches „Depot“ für Phosphor, Magnesium und andere Verbindungen, die zur Aufrechterhaltung der Homöostase im Mineralstoffwechsel notwendig sind. Seine Struktur umfasst dichte Mineralbestandteile, die eng mit der organischen Matrix verwandt sind, die zu 90–95 % aus Kollagen, geringen Mengen Mukopolysacchariden und nichtkollagenen Proteinen besteht. Der mineralische Anteil des Knochens besteht aus Hydroxylapatit – seine Summenformel lautet Ca10 (PO4) 6 (OH) 2 – und amorphem Calciumphosphat.
Knochen wird von Osteoblasten gebildet, die aus undifferenzierten Mesenchymzellen stammen. Diese mononukleären Zellen sind an der Synthese von Komponenten der organischen Knochenmatrix beteiligt. Sie befinden sich in einer Monoschicht auf der Knochenoberfläche und stehen in engem Kontakt mit Osteoid. Osteoblasten sind für die Ablagerung von Osteoid und dessen anschließende Mineralisierung verantwortlich. Das Produkt ihrer lebenswichtigen Aktivität ist alkalische Phosphatase, deren Gehalt im Blut ein indirekter Indikator für ihre Aktivität ist. Umgeben von mineralisiertem Osteoid verwandeln sich einige Osteoblasten in Osteozyten – mononukleäre Zellen, deren Zytoplasma Kanäle bildet, die mit den Kanälen benachbarter Osteozyten verbunden sind. Sie sind nicht am Knochenumbau beteiligt, sondern am Prozess der perilacunaren Zerstörung, der für die schnelle Regulierung des Kalziumspiegels im Blutserum wichtig ist. Die Knochenresorption wird von Osteoklasten durchgeführt – riesigen polynukleären Zellen, die offenbar durch die Fusion mononukleärer Makrophagen entstehen. Es wird auch angenommen, dass die Vorläufer der Osteoklasten hämatopoetische Stammzellen des Knochenmarks sein könnten. Sie sind mobil, bilden eine Schicht in Kontakt mit dem Knochen und befinden sich in Bereichen seiner stärksten Resorption. Durch die Freisetzung von proteolytischen Enzymen und saurer Phosphatase verursachen Osteoklasten Kollagenabbau, Zerstörung von Hydroxylapatit und die Entfernung von Mineralien aus der Matrix. Neu gebildetes, schlecht mineralisiertes Knochengewebe (Osteoid) ist resistent gegen osteoklastische Resorption. Die Funktionen von Osteoblasten und Osteoklasten sind unabhängig, aber aufeinander abgestimmt, was zu einem normalen Skelettumbau führt. Das Längenwachstum des Knochens hängt von der enchondralen Ossifikation ab, das Breiten- und Dickenwachstum von der periostalen Ossifikation. Klinische Studien mit 47 Ca haben gezeigt, dass jedes Jahr bis zu 18 % des gesamten Kalziumgehalts im Skelett erneuert werden. Bei Knochenschäden (Frakturen, infektiöse Prozesse) wird der veränderte Knochen resorbiert und neuer Knochen gebildet.
Zellkomplexe, die am lokalen Prozess der Knochenresorption und -bildung beteiligt sind, werden als grundlegende multizelluläre Remodellierungseinheiten (BMUs) bezeichnet. Sie regulieren die lokale Konzentration von Kalzium, Phosphor und anderen Ionen, die Synthese organischer Knochenbestandteile, insbesondere Kollagen, sowie deren Organisation und Mineralisierung.
Die Hauptwirkung des Parathormons im Knochen des Skeletts besteht in der Verstärkung der Resorptionsprozesse, die sowohl mineralische als auch organische Bestandteile der Knochenstruktur beeinflussen. Parathormon fördert das Wachstum und die Aktivität von Osteoklasten, was mit einer verstärkten osteolytischen Wirkung und einer erhöhten Knochenresorption einhergeht. Dabei lösen sich Hydroxylapatitkristalle auf, wobei Kalzium und Phosphor ins Blut freigesetzt werden. Dieser Prozess ist der Hauptmechanismus zur Erhöhung des Kalziumspiegels im Blut. Er besteht aus drei Komponenten: Mobilisierung von Kalzium aus dem perilacunaren Knochen (tiefe Osteozyten); Proliferation osteoprogeneratorischer Zellen zu Osteoklasten; Aufrechterhaltung eines konstanten Kalziumspiegels im Blut durch Regulierung der Kalziumfreisetzung aus dem Knochen (oberflächliche Osteozyten).
So erhöht Parathormon zunächst die Aktivität von Osteozyten und Osteoklasten, verstärkt die Osteolyse, führt zu einem Anstieg des Kalziumspiegels im Blut und einer erhöhten Ausscheidung von Kalzium und Oxyprolin im Urin. Dies ist die erste qualitative und schnelle Wirkung von Parathormon. Die zweite Wirkung von Parathormon auf die Knochen ist quantitativ. Sie ist mit einer Zunahme des Osteoklastenpools verbunden. Bei aktiver Osteolyse entsteht ein Stimulus für eine vermehrte Proliferation von Osteoblasten, sowohl die Resorption als auch die Knochenbildung mit überwiegender Resorption werden aktiviert. Bei einem Überschuss an Parathormon kommt es zu einer negativen Knochenbilanz. Dies geht mit einer übermäßigen Ausscheidung von Oxyprolin einher – einem Produkt des Kollagenabbaus und von Sialinsäuren, die in der Struktur von Mukopolysacchariden enthalten sind. Parathormon aktiviert zyklisches Adenosinmonophosphat (cAMP). Eine erhöhte Ausscheidung von cAMP im Urin nach der Gabe von Parathormon kann als Indikator für die Gewebeempfindlichkeit dienen.
Die wichtigste Wirkung des Parathormons auf die Nieren ist seine Fähigkeit, die Phosphorreabsorption zu verringern und so die Phosphaturie zu verstärken. Der Mechanismus der Verringerung ist in verschiedenen Teilen des Nephrons unterschiedlich: Im proximalen Teil beruht dieser Effekt des Parathormons auf einer erhöhten Permeabilität und tritt unter Beteiligung von cAMP auf, während er im distalen Teil nicht von cAMP abhängt. Die phosphaturische Wirkung des Parathormons verändert sich bei Vitamin-D-Mangel, metabolischer Azidose und verringertem Phosphorgehalt. Parathormon erhöht leicht die gesamte tubuläre Calciumreabsorption. Gleichzeitig verringert es sie in den proximalen Teilen und erhöht sie in den distalen Teilen. Letzteres ist von größter Bedeutung – Parathormon verringert die Calcium-Clearance. Parathormon verringert die tubuläre Reabsorption von Natrium und seinem Bicarbonat, was die Entwicklung einer Azidose bei Hyperparathyreoidismus erklären könnte. Es erhöht die Bildung von 1,25-Dioxycholecalciferol 1,25(OH 2 )D 3 in den Nieren – der aktiven Form von Vitamin D 3. Diese Verbindung erhöht die Calciumresorption im Dünndarm, indem sie die Aktivität eines spezifischen Calcium-bindenden Proteins (CaBP) in der Dünndarmwand stimuliert.
Der normale Parathormonspiegel liegt im Durchschnitt bei 0,15–0,6 ng/ml. Er variiert je nach Alter und Geschlecht. Der durchschnittliche Parathormonspiegel im Blut von Menschen im Alter von 20–29 Jahren beträgt (0,245 ± 0,017) ng/ml, bei 80–89 Jahren (0,545 ± 0,048) ng/ml; der Parathormonspiegel bei 70-jährigen Frauen beträgt (0,728 ± 0,051) ng/ml, bei gleichaltrigen Männern (0,466 ± 0,40) ng/ml. Somit steigt der Parathormonspiegel mit dem Alter, bei Frauen jedoch stärker.
Zur Differentialdiagnose einer Hyperkalzämie sollten grundsätzlich mehrere unterschiedliche Untersuchungen durchgeführt werden.
Wir präsentieren die von uns entwickelte klinische und pathogenetische Klassifikation, basierend auf der Klassifikation von OV Nikolaev und VN Tarkaeva (1974).
Klinische und pathogenetische Klassifikation von Erkrankungen, die mit einer gestörten Sekretion des Parathormons und seiner Empfindlichkeit verbunden sind
Primärer Hyperparathyreoidismus
- Nach Pathogenese:
- hyperfunktionelles Adenom(e);
- Hyperplasie der OGD;
- hyperfunktionales Nebenschilddrüsenkarzinom;
- multiple endokrine Neoplasie Typ I mit Hyperparathyreoidismus (Wermer-Syndrom);
- Multiple endokrine Neoplasie Typ II mit Hyperparathyreoidismus (Sipple-Syndrom).
- Nach klinischen Merkmalen:
- Knochenform:
- osteoporotisch,
- fibrozystische Osteitis,
- "Pagetoid";
- viszeropathische Form:
- mit überwiegender Schädigung der Nieren, des Magen-Darm-Trakts und des neuropsychiatrischen Bereichs;
- Mischform.
- Knochenform:
- Stromabwärts:
- scharf;
- chronisch.
Sekundärer Hyperparathyreoidismus (sekundäre Überfunktion und Hyperplasie der Nebenschilddrüsen mit anhaltender Hypokalzämie und Hyperphosphatämie)
- Nierenpathologie:
- chronisches Nierenversagen;
- Tubulopathie (Typ Albright-Fanconi);
- Nierenrachitis.
- Darmpathologie:
- Malabsorptionssyndrom.
- Knochenpathologie:
- senile Osteomalazie;
- Wochenbett;
- idiopathisch;
- Morbus Paget.
- Vitamin-D-Mangel:
- Nierenerkrankung;
- Leber;
- erbliche Enzymmängel.
- Bösartige Erkrankungen: Myelom.
Tertiärer Hyperparathyreoidismus
- Autonom funktionierende Adenome der Nebenschilddrüsen, die sich vor dem Hintergrund eines langjährigen sekundären Hyperparathyreoidismus entwickeln.
Pseudohyperparathyreoidismus
- Produktion von Parathormon durch Tumoren nicht-parathormonbedingten Ursprungs.
Hormonell inaktive Zysten- und Tumorbildungen der Nebenschilddrüsen
- Zyste.
- Hormonell inaktive Tumoren oder Karzinome.
Hypoparathyreoidismus
- Angeborene Unterentwicklung oder Fehlen der Nebenschilddrüsen.
- Idiopathischer, autoimmuner Ursprung.
- Postoperativ, entwickelt im Zusammenhang mit der Entfernung der Nebenschilddrüsen.
- Postoperativ aufgrund einer gestörten Blutversorgung und Innervation.
- Strahlenschäden, exogen und endogen (externe Strahlentherapie, Behandlung von Schilddrüsenerkrankungen mit radioaktivem Jod).
- Schädigung der Nebenschilddrüsen durch Blutung oder Infarkt.
- Infektiöse Läsionen.
Pseudohypoparathyreoidismus
- Typ I – Unempfindlichkeit der Zielorgane gegenüber Parathormon, abhängig von Adenylatcyclase;
- Typ II – Unempfindlichkeit der Zielorgane gegenüber Parathormon, unabhängig von der Adenylatcyclase, möglicherweise autoimmunen Ursprungs.
Pseudopseudohypoparathyreoidismus
Das Vorhandensein somatischer Anzeichen eines Pseudohypoparathyreoidismus bei gesunden Verwandten in Familien von Patienten mit Pseudohypoparathyreoidismus ohne charakteristische biochemische Störungen und ohne Tetanus.
 [ 13 ], [ 14 ], [ 15 ], [ 16 ], [ 17 ], [ 18 ], [ 19 ], [ 20 ], [ 21 ]
[ 13 ], [ 14 ], [ 15 ], [ 16 ], [ 17 ], [ 18 ], [ 19 ], [ 20 ], [ 21 ]
Использованная литература

