
Alle iLive-Inhalte werden medizinisch überprüft oder auf ihre Richtigkeit überprüft.
Wir haben strenge Beschaffungsrichtlinien und verlinken nur zu seriösen Medienseiten, akademischen Forschungseinrichtungen und, wenn möglich, medizinisch begutachteten Studien. Beachten Sie, dass die Zahlen in Klammern ([1], [2] usw.) anklickbare Links zu diesen Studien sind.
Wenn Sie der Meinung sind, dass einer unserer Inhalte ungenau, veraltet oder auf andere Weise bedenklich ist, wählen Sie ihn aus und drücken Sie Strg + Eingabe.
Membrancholesterin: ein neues Ziel bei Darmkrebs
Zuletzt überprüft: 09.08.2025
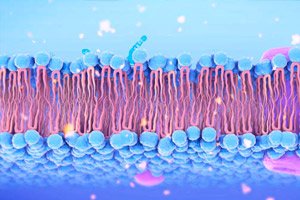 ">
">Kolorektales Karzinom (CRC) wird häufig mit Mutationen im APC-Suppressorgen in Verbindung gebracht, die zu einer unkontrollierten Aktivierung der Wnt-Signalgebung und Tumorwachstum führen. In einer neuen Übersichtsarbeit in Trends in Pharmacological Sciences beschreiben Cho et al. detailliert, wie APC-Defekte zur Ansammlung von freiem Cholesterin auf der Zellmembran führen, was durch Veränderung der physikochemischen Eigenschaften der Lipiddoppelschicht die Wnt-Signalgebung über den Schlüsselmediator Dishevelled (Dvl) und den Transkriptor β-Catenin verstärkt.
Was passiert auf Membranebene?
Regulierung des Cholesterins durch APC
Normales APC ist an der Endozytose und Nutzung von Membrancholesterin beteiligt und hält dessen optimalen Spiegel aufrecht.
Wenn APC mutiert, wird diese Kontrolle gestört und überschüssiges freies Cholesterin verklumpt in Bereichen der Membran.
Membranversiegelung und Dvl-Lokalisierung
Der erhöhte Cholesterinanteil macht die Membran steifer und fördert die Ansammlung von Mikrodomänen, in denen sich die Bindungsstellen des Wnt-Rezeptors befinden.
Dvl, ein zentraler Adapter im Wnt-Signalweg, ist eng mit diesen Domänen verbunden, was seine Signalübertragung an β-Catenin verstärkt.
Aktivierte Transduktion
Eine langfristige Aktivierung von Dvl erhöht den zytosolischen β-Cateninspiegel, seine Translokation in den Zellkern und die Einleitung der proliferativen Transkription, was das Wachstum und Überleben von Krebszellen stimuliert.
Experimentelle Beweise und therapeutische Strategien
- Organoide und Zelllinien: Bei der Behandlung mit spezifischen Cholesterin-verkaufenden Liganden oder Membranstabilisatoren beobachteten wir eine Abnahme der Dvl-Clusterbildung, einen Rückgang der β-Catenin-Aktivität und eine Hemmung des Wachstums von CRC-Organoiden.
- Mausmodelle: Die systemische oder lokale Verabreichung von Medikamenten, die Cholesterin aus Membranmikrodomänen verdrängen, führte zu einer 40–60%igen Verlangsamung des Tumorwachstums ohne signifikante Toxizität für normales Gewebe.
Vorteile des neuen Ansatzes
Anstatt β-Catenin direkt anzugreifen
, werden die beliebten, aber schwer erreichbaren intrazellulären Onkoproteine durch Membrancholesterin ersetzt, ein leichter zugängliches Ziel.Hohe Selektivität
– durch die lokale Verabreichung (Hydrogele, Liposomen) ist es möglich, die Wirkung von Medikamenten im Tumorbereich zu begrenzen und systemische Effekte zu vermeiden.Neupositionierung
– Viele statinähnliche und membranstabilisierende Verbindungen sind bereits für andere Indikationen zugelassen und können in der CRC-Klinik schnell getestet werden.
Autorenzitate
„Der Verlust von APC ist nicht nur ein molekularer Fehler im Wnt-Signalweg, sondern auch ein Membranphänomen: Überschüssiges freies Cholesterin setzt die Steifheit der Lipiddoppelschicht herab und verstärkt die lokale Aktivierung von Dvl“, erklärt A. Erazo-Oliveras, leitender Autor der Studie.
„Die gezielte Behandlung von Membrancholesterin eröffnet einen neuen Weg für die Präzisionstherapie von CRC: Es ist viel einfacher, in die Membranzusammensetzung einzugreifen, als nach dem β-Catenin-Kern zu suchen“, fügt V. Cho hinzu.
Nächste Schritte
- Klinische Studien: Phase I/II für Cholesterinmodulatoren in Kombination mit Chemotherapie und Immuntherapie.
- Individualisierung der Behandlung: Stratifizierung der Patienten nach APC-Mutation und Membrancholesterinstatus für maximalen Nutzen.
- Sicherheitsüberwachung: Untersuchung der Auswirkungen einer langfristigen Cholesterinmodulation auf die Funktionen anderer Gewebe.
Diese Entdeckung erklärt nicht nur einen neuen mechanistischen Aspekt der Wnt-Aktivierung bei Dickdarmkrebs, sondern ebnet auch den Weg für eine „Membrantherapie“, bei der Cholesterin zur Achillesferse des Tumors wird.
