
Alle iLive-Inhalte werden medizinisch überprüft oder auf ihre Richtigkeit überprüft.
Wir haben strenge Beschaffungsrichtlinien und verlinken nur zu seriösen Medienseiten, akademischen Forschungseinrichtungen und, wenn möglich, medizinisch begutachteten Studien. Beachten Sie, dass die Zahlen in Klammern ([1], [2] usw.) anklickbare Links zu diesen Studien sind.
Wenn Sie der Meinung sind, dass einer unserer Inhalte ungenau, veraltet oder auf andere Weise bedenklich ist, wählen Sie ihn aus und drücken Sie Strg + Eingabe.
Neuartige genetische Mechanismen könnten ein therapeutisches Ziel gegen Gliome sein
Zuletzt überprüft: 02.07.2025
 ">
">Eine Studie aus dem Labor von Dr. Shi-Yuan Cheng, Professor in der Ken-und-Ruth-Davey-Abteilung für Neuroonkologie der Klinik für Neurologie, hat neue Mechanismen identifiziert, die alternativen RNA-Spleißen in Gliomtumorzellen zugrunde liegen und als neue therapeutische Angriffspunkte dienen könnten. Die Studienergebnisse wurden im Journal of Clinical Investigation veröffentlicht.
„Wir haben durch alternatives Spleißen einen anderen Weg zur Behandlung von Gliomen gefunden und neue Ziele entdeckt, die zuvor noch nicht identifiziert wurden, aber für die Malignität von Gliomen wichtig sind“, sagte Xiao Song, MD, PhD, außerordentlicher Professor für Neurologie und Hauptautor der Studie.
Gliome sind die häufigste Form primärer Hirntumore bei Erwachsenen. Sie entstehen aus Gliazellen, die im zentralen Nervensystem vorkommen und benachbarte Neuronen unterstützen. Aufgrund ihrer genetischen und epigenetischen Heterogenität reagieren Gliome sehr resistent auf Standardbehandlungen wie Strahlen- und Chemotherapie. Dies unterstreicht die Notwendigkeit, neue therapeutische Ziele zu finden.
Frühere Forschungsergebnisse des Cheng-Labors, die in der Fachzeitschrift Cancer Research veröffentlicht wurden, zeigten, dass der wichtige Spleißfaktor SRSF3 in Gliomen im Vergleich zu normalen Gehirnen deutlich erhöht ist und dass das SRSF3-regulierte RNA-Spleißen das Wachstum und die Progression von Gliomen fördert, indem es mehrere zelluläre Prozesse in Tumorzellen beeinflusst.
Beim RNA-Spleißen handelt es sich um einen Prozess, bei dem Introns (nicht-kodierende Bereiche der RNA) entfernt und Exons (kodierende Bereiche) zusammengefügt werden, um ein reifes mRNA-Molekül zu bilden, das die Genexpression in einer Zelle unterstützt.
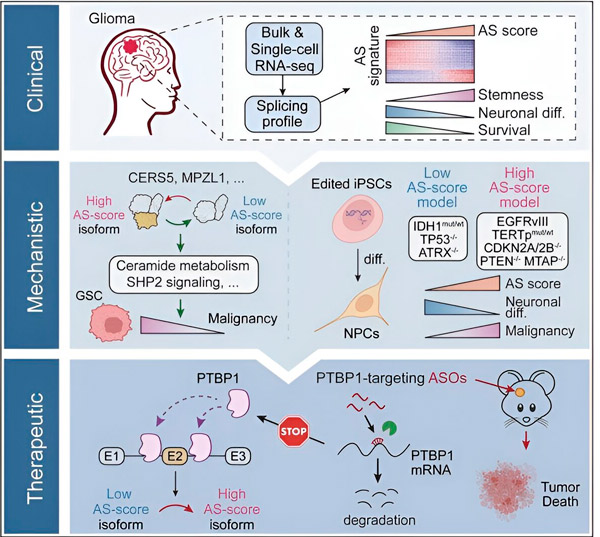
In der vorliegenden Studie wollten die Wissenschaftler Veränderungen beim alternativen Spleißen in Gliomtumorzellen sowie die diesen Veränderungen zugrunde liegenden Mechanismen identifizieren und ihr Potenzial als therapeutische Ziele bestimmen.
Mithilfe computergestützter Methoden und RNA-Sequenzierungstechnologien untersuchten die Forscher Spleißveränderungen in Gliomtumorzellen aus Patientenproben. Um diese Veränderungen zu bestätigen, nutzten sie CRISPR-Geneditierungstechnologien, um verschiedene Gliom-Treibermutationen in Gliommodelle einzuführen, die aus humanen induzierten pluripotenten Stammzellen (iPSCs) gewonnen wurden.
Sie fanden heraus, dass diese Spleißänderungen durch eine Variante des epidermalen Wachstumsfaktorrezeptors III (EGFRIII) verstärkt werden, von dem bekannt ist, dass er in vielen Tumoren, einschließlich Gliomen, überexprimiert wird, und durch eine Mutation im IDH1-Gen gehemmt werden.
Forscher haben die Funktion zweier RNA-Spleißereignisse bestätigt, die unterschiedliche Proteinisoformen mit unterschiedlichen Aminosäuresequenzen erzeugen.
„Nur eine dieser Isoformen kann das Tumorwachstum fördern, im Gegensatz zur anderen Isoform, die normalerweise im normalen Gehirn exprimiert wird. Tumore nutzen diesen Mechanismus aus, um die tumorfördernde Isoform selektiv gegenüber der normalen Gehirn-Isoform zu exprimieren“, sagte Song.
Das Team analysierte anschließend vorgelagerte RNA-bindende Proteine und stellte fest, dass das PTBP1-Gen das tumorfördernde RNA-Spleißen in Gliomzellen reguliert. Mithilfe eines orthotopen Gliommodells in immundefizienten Mäusen zielten die Forscher mit einer Antisense-Oligonukleotid (ASO)-basierten Therapie auf PTBP1 ab, was letztendlich das Tumorwachstum unterdrückte.
„Unsere Daten unterstreichen die Rolle des alternativen RNA-Spleißens bei der Beeinflussung der Malignität und Heterogenität von Gliomen und sein Potenzial als therapeutische Schwachstelle für die Behandlung von Gliomen bei Erwachsenen“, schrieben die Autoren der Studie.
Der nächste Schritt für die Forscher bestehe darin, das Potenzial der gezielten Ansteuerung von PTBP1 zu untersuchen, um eine Anti-Tumor-Immunreaktion hervorzurufen, sagte Song.
„Durch die Analyse von RNA-Sequenzen mit langen Leseabschnitten haben wir herausgefunden, dass die gezielte Aktivierung von PTBP1 in Gliomzellen zur Produktion mehrerer alternativ gespleißter Transkripte führt, die in normalem Gewebe fehlen. Unser nächstes Projekt besteht daher darin, herauszufinden, ob diese Isoform Antigene erzeugen kann, sodass das Immunsystem den Tumor besser erkennen kann“, sagte Song.
Song fügte außerdem hinzu, dass sein Team an der Analyse von Spleißänderungen in Nicht-Tumorzellen von Gliompatienten, wie beispielsweise Immunzellen, interessiert sei.
„Wir wissen bereits, dass das Spleißen für die Regulierung der Zellfunktionen sehr wichtig ist. Es sollte daher nicht nur die Tumormalignität regulieren, sondern auch die Funktion von Immunzellen steuern und so bestimmen, ob diese Krebszellen wirksam bekämpfen können. Daher führen wir auch einige bioinformatische Analysen an tumorinfiltrierten Immunzellen durch, um zu sehen, ob sich das Spleißen verändert, nachdem eine Immunzelle den Tumor infiltriert hat.
„Unser Ziel ist es, die Rolle des alternativen Spleißens bei der Gestaltung der immunsuppressiven Tumormikroumgebung zu bestimmen und potenzielle Ziele zur Verbesserung der Wirksamkeit von Immuntherapien bei Gliomen zu identifizieren“, sagte Song.
