
Alle iLive-Inhalte werden medizinisch überprüft oder auf ihre Richtigkeit überprüft.
Wir haben strenge Beschaffungsrichtlinien und verlinken nur zu seriösen Medienseiten, akademischen Forschungseinrichtungen und, wenn möglich, medizinisch begutachteten Studien. Beachten Sie, dass die Zahlen in Klammern ([1], [2] usw.) anklickbare Links zu diesen Studien sind.
Wenn Sie der Meinung sind, dass einer unserer Inhalte ungenau, veraltet oder auf andere Weise bedenklich ist, wählen Sie ihn aus und drücken Sie Strg + Eingabe.
Die Studie unterstreicht den Bedarf an zelltypspezifischen Therapien für HIV
Zuletzt überprüft: 02.07.2025
Forscher der University of Illinois haben gezeigt, wie wichtig die gezielte Behandlung spezifischer Zelltypen bei der Behandlung von HIV ist. Ihre in der Fachzeitschrift Proceedings of the National Academy of Sciences veröffentlichte Studie ist eine der ersten, die die differenziellen bzw. zelltypspezifischen Auswirkungen der HIV-Latenzmodulation auf myeloide Zellen, einen im Knochenmark produzierten Immunzelltyp, untersucht.
Eines der Haupthindernisse bei der Eliminierung der HIV-Infektion ist die Kontrolle der Latenzzeit, also der Zeit, in der eine infizierte Zelle inaktiv ist und keine Viren produzieren kann. Latente HIV-Zellen sammeln sich im Körper an sogenannten Reservoirs. Latente Reservoirs sind problematisch, da sie jederzeit mit der Virusproduktion beginnen können.
Eine vollständige Ausrottung der Krankheit würde die Entfernung aller latenten Zellen aus dem Körper oder eine dauerhafte Resistenz gegen Aktivierungsreize erfordern. Eine Reaktivierung kann jedoch durch verschiedene Faktoren ausgelöst werden, darunter Signale, die die Differenzierung myeloider Zellen steuern.
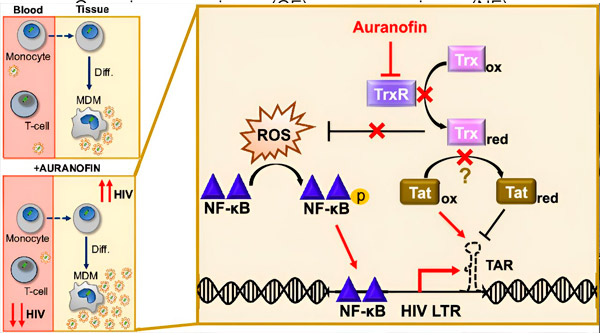
Die Regulierung der HIV-Latenz in Monozyten-abgeleiteten Makrophagen (MDMs) kann ein Risiko für die Virusverbreitung darstellen. Die Differenzierung von Monozyten zu Makrophagen kann eine HIV-Reaktivierung auslösen und so potenziell die Virusverbreitung in Geweben fördern (oben links). Ein klinischer Kandidat, Auranofin, reduziert die virale DNA im Blut und fördert die HIV-Latenz in T-Zellen und Monozyten, verursacht jedoch eine HIV-Reaktivierung in MDMs (unten links). Wir gehen davon aus, dass die Hemmung von TrxR durch Auranofin in MDMs zur Akkumulation reaktiver Sauerstoffspezies (ROS) führt, die die Aktivierung von NF-κB und des HIV-LTR-Promotors induzieren (rechts). Die Hemmung von TrxR reduziert potenziell die Substratreduktion, wodurch das Tat-Protein bevorzugt oxidiert bleibt, wo es an TAR binden und die HIV-Transkription initiieren kann. Quelle: Proceedings of the National Academy of Sciences (2024). DOI: 10.1073/pnas.2313823121
Seit Jahren konzentriert sich die HIV-Heilungsforschung auf zwei Ansätze, die als „Shock and Kill“ und „Block and Lock“ bekannt sind. Ersteres aktiviert in Kombination mit einer antiretroviralen Therapie latent infizierte Zellen und tötet sie durch Apoptose, den programmierten Zelltod, ab. Letzteres zwingt infizierte Zellen in einen tiefen Latenzzustand, aus dem sie sich nicht mehr selbstständig reaktivieren können.
Die Forschung zu diesen Techniken konzentrierte sich traditionell auf einen Typ weißer Blutkörperchen, die sogenannten T-Zellen, die das primäre Ziel einer HIV-Infektion sind. Latente Reservoirs bestehen jedoch aus mehr als nur T-Zellen; sie enthalten Dutzende verschiedener Zelltypen, jeder mit seinem eigenen, einzigartigen Muster der HIV-Genexpression.
„Es gibt eine enorme Zellvielfalt, selbst innerhalb einer einzigen Linie“, sagte Collin Kieffer, Assistenzprofessor für Mikrobiologie und Autor der Studie. „Die Variabilität der Reaktion in diesen Reservoirs nimmt mit jedem neuen Zelltyp zu.“
Alexandra Blanco, Doktorandin in Kieffers Labor, wollte Zelltypen untersuchen, die in der traditionellen HIV-Forschung bisher übersehen worden waren. Ausgehend von myeloiden Zellen erstellte sie eine Klonbibliothek mit 70 Populationen latent infizierter Monozyten. Anschließend analysierte Blanco die Klonpopulationen und ihre Reaktionen auf die Aktivierung. Die Reaktionen variierten stark, was die große Vielfalt innerhalb eines einzelnen Zelltyps verdeutlichte.
Diese Beobachtung warf eine neue Frage auf: Reagieren verschiedene Zelltypen tatsächlich unterschiedlich auf HIV-Latenzbehandlungen? Ihre Ergebnisse zeigten tatsächlich, dass einige HIV-Latenztherapien die Latenz in T-Zellen und Monozyten fördern und die Latenz in Makrophagen umkehren können.
„Nicht alle Zellen im Körper sind gleich“, sagte Kieffer. „Daher ist es verständlich, dass nicht alle infizierten Zellen gleich auf das Virus reagieren.“
Ihr Artikel unterstreicht, dass bei zukünftigen HIV-Behandlungen alle Zelltypen und die mögliche Reaktion jeder einzelnen Zelle auf mögliche Therapien berücksichtigt werden müssen.
Ihre Erkenntnisse basieren auf der Forschung von Roy Dar, einem ehemaligen Bioingenieursprofessor aus Illinois, dessen Labor die Heterogenität der HIV-Genexpression untersuchte.
„Er hat damit begonnen, wir haben es übernommen und zu dem gemacht, was es heute ist“, sagte Kieffer. „Die Zusammenarbeit hat diese Ergebnisse erst möglich gemacht. Sie hat unserem Labor eine neue Richtung gegeben, und wir sind wirklich begeistert davon.“
Ein weiteres und unerwartetes Ergebnis von Blancos Analyse zeigte Veränderungen der Zellgröße und -form als Reaktion auf eine Infektion. Dies deutet darauf hin, dass HIV die Zellmorphologie verändern kann. Blancos nächstes Ziel ist es, die biologischen Mechanismen zu identifizieren, die diesen phänotypischen Veränderungen zugrunde liegen.
Kieffer und seine Labormitarbeiter freuen sich darauf, ihre Ergebnisse, die größtenteils in einer Zelllinie erzielt wurden, in Primärzellen zu reproduzieren. Die Reproduktion der Ergebnisse in einem menschenähnlicheren Modell würde die klinische Relevanz der Studie verbessern, erklärte Kieffer.
„Wir möchten größere Screenings an T-Zellen, Monozyten und Makrophagen durchführen, um potenzielle Medikamente zu identifizieren, die bei all diesen Zelltypen wirken könnten“, sagte Blanco. „Vielleicht finden wir sogar noch mehr Moleküle, die sich nicht zelltypspezifisch verhalten.“
