
Alle iLive-Inhalte werden medizinisch überprüft oder auf ihre Richtigkeit überprüft.
Wir haben strenge Beschaffungsrichtlinien und verlinken nur zu seriösen Medienseiten, akademischen Forschungseinrichtungen und, wenn möglich, medizinisch begutachteten Studien. Beachten Sie, dass die Zahlen in Klammern ([1], [2] usw.) anklickbare Links zu diesen Studien sind.
Wenn Sie der Meinung sind, dass einer unserer Inhalte ungenau, veraltet oder auf andere Weise bedenklich ist, wählen Sie ihn aus und drücken Sie Strg + Eingabe.
Ursachen und Pathogenese der Diphtherie
Facharzt des Artikels
Zuletzt überprüft: 04.07.2025
Diphtherie ist ein Paradebeispiel für toxinbedingte Infektionskrankheiten. 1883 wies Klebs nach, dass Corynebacterium diphtheriae der Erreger der Diphtherie ist. Ein Jahr später stellte Loeffler fest, dass der Organismus nur im Nasen-Rachen-Raum kultiviert werden konnte, und vermutete, dass die Schädigung der inneren Organe auf ein lösliches Toxin zurückzuführen sei. 1888 zeigten Roux und Yersin, dass Tiere, denen sterile Filtrate von C. diphtheriae injiziert wurden, Organpathologien entwickelten, die von denen der menschlichen Diphtherie nicht zu unterscheiden waren; dies belegte, dass ein potentes Exotoxin der wichtigste Virulenzfaktor war.
Diphtherie ist meist eine Infektion der oberen Atemwege, die Fieber, Halsschmerzen und Unwohlsein verursacht. An der Infektionsstelle bildet sich häufig eine dicke, graugrüne Fibrinmembran, eine Pseudomembran, als Folge der kombinierten Effekte von Bakterienwachstum, Toxinproduktion, darunterliegender Gewebenekrose und der Immunreaktion des Wirts. Die Erkenntnis, dass systemische Organschäden durch die Wirkung des Diphtherietoxins verursacht werden, hat zur Entwicklung einer wirksamen antitoxinbasierten Therapie zur Behandlung akuter Infektionen und eines hochwirksamen Toxoid-Impfstoffs geführt.
Obwohl Diphtherie in Gebieten, in denen die öffentlichen Gesundheitsstandards eine Impfung vorschreiben, durch die Toxoid-Impfung zu einer seltenen Krankheit geworden ist, kommt es in nicht immunisierten und immungeschwächten Gruppen immer noch zu Diphtherieausbrüchen. Im Gegensatz dazu kam es in Gebieten, in denen aktive Impfprogramme ausgesetzt wurden, zu großflächigen Diphtherieausbrüchen mit epidemischem Ausmaß.
Andere Arten von Corynebakterien
Neben C. diphtheriae, C. ulcerans und C. pseudotuberculosis können auch C. pseudodiphtheriticum und C. xerosis gelegentlich Infektionen des Nasen-Rachen-Raums und der Haut verursachen. Die beiden letztgenannten Stämme sind an ihrer Fähigkeit zur Pyrazinamidase-Produktion erkennbar. In der Veterinärmedizin sind C. renale und C. kutscheri wichtige Erreger, die bei Rindern Pyelonephritis bzw. bei Mäusen latente Infektionen verursachen.
Ursachen
Der Erreger der Diphtherie, Corynebacterium diphtheriae, ist ein dünnes, leicht gebogenes Stäbchen mit keulenförmigen Verdickungen an den Enden, bewegungslos; es bildet keine Sporen, Kapseln oder Geißeln und ist grampositiv.
Neben dem Toxin produzieren Diphtherie-Corynebakterien während ihrer Lebensprozesse Neuraminidase, Hyaluronidase, Hämolysin, nekrotisierende und diffuse Faktoren, die zur Nekrose und Verflüssigung der Grundsubstanz des Bindegewebes führen können.
Aufgrund ihrer Fähigkeit zur Toxinbildung werden Diphtherie-Corynebakterien in toxigene und nicht-toxigene Bakterien unterteilt.
Diphtherie-Toxin ist ein potentes bakterielles Exotoxin, das sowohl die allgemeinen als auch die lokalen klinischen Manifestationen der Krankheit bestimmt. Die Toxigenität ist genetisch bedingt. Nicht-toxigene Corynebakterien der Diphtherie verursachen die Krankheit nicht.
Nach kulturellen und morphologischen Merkmalen werden alle Diphtherie-Corynebakterien in drei Varianten unterteilt: gravis, mitis und intermedius. Die Schwere der Erkrankung hängt nicht direkt von der Variante der Diphtherie-Corynebakterien ab. Jede Variante enthält sowohl toxigene als auch nicht-toxigene Stämme. Toxigene Corynebakterien aller Varianten produzieren ein identisches Toxin. [ 1 ]
Struktur, Klassifizierung und Antigentypen
Corynebacterium diphtheriae ist ein grampositives, unbewegliches, keulenförmiges Stäbchen. In Gewebe oder älteren In-vitro-Kulturen wachsende Stämme weisen feine Flecken in den Zellwänden auf, die eine Entfärbung bei der Gram-Färbung ermöglichen und zu einer variablen Gram-Reaktion führen. Ältere Kulturen enthalten häufig metachromatische Granula (Polymetaphosphat), die sich mit Methylenblau bläulich-violett färben. Zu den Zellwandzuckern zählen Arabinose, Galaktose und Mannose. Darüber hinaus kann der toxische 6,6'-Ester der Trehalose isoliert werden, der Corynemycolsäure und Corynemycolensäure in äquimolaren Konzentrationen enthält. Drei verschiedene Kulturtypen werden unterschieden: mitis, intermedius und gravis.
Die meisten Stämme benötigen Nicotinsäure und Pantothensäure für ihr Wachstum; manche benötigen zusätzlich Thiamin, Biotin oder Pimelinsäure. Für eine optimale Diphtherietoxinproduktion muss das Medium mit Aminosäuren ergänzt und beiseitegestellt werden.
Bereits 1887 beschrieb Loeffler die Isolierung avirulenter (nicht toxigener) C. diphtheriae-Stämme, die von virulenten (toxigenen) Stämmen, die aus gesunden Patienten isoliert wurden, nicht zu unterscheiden waren. Es ist heute bekannt, dass avirulente C. diphtheriae-Stämme nach Infektion und Lysogenisierung durch einen von mehreren Corynebakteriophagen, die das Strukturgen für das Diphtherie-Toxin (tox) tragen, in einen virulenten Phänotyp umgewandelt werden können. Die lysogene Umwandlung des avirulenten in einen virulenten Phänotyp kann sowohl in situ als auch in vitro erfolgen. Das Strukturgen für das Diphtherie-Toxin ist weder für Corynebakteriophagen noch für C. diphtheriae essentiell. Trotz dieser Beobachtung wurde keine genetische Drift des Diphtherie-Toxins beobachtet.
Pathogenese
Eintrittspunkte der Infektion sind die Schleimhäute von Mund-Rachenraum, Nase, Kehlkopf, seltener die Schleimhäute der Augen und Genitalien sowie geschädigte Haut, Wund- oder Brandflächen, Windelausschlag und nicht verheilte Nabelwunden. Am Eintrittspunkt vermehrt sich das Diphtherie-Corynebakterium und sondert Exotoxin ab.
Fibrinogenreiches Exsudat wird ausgeschieden und unter dem Einfluss der bei der Nekrose von Epithelzellen freigesetzten Thrombokinase in Fibrin umgewandelt. Es bildet sich ein fibrinöser Film – ein charakteristisches Zeichen der Diphtherie.
Asymptomatische nasopharyngeale Infektionen sind in Diphtherie-Endemiegebieten häufig. Bei anfälligen Personen verursachen toxigene Stämme die Erkrankung durch Replikation und Sekretion von Diphtherie-Toxin im Nasopharynx oder in Hautläsionen. Die Diphtherieläsion ist häufig von einer Pseudomembran aus Fibrin, Bakterien und Entzündungszellen bedeckt. Diphtherie-Toxin kann proteolytisch in zwei Fragmente gespalten werden: das N-terminale Fragment A (katalytische Domäne) und Fragment B (transmembranäre und rezeptorbindende Domänen). Fragment A katalysiert die NAD+-abhängige ADP-Ribosylierung des Elongationsfaktors 2 und hemmt dadurch die Proteinsynthese in eukaryotischen Zellen. Fragment B bindet an einen Zelloberflächenrezeptor und erleichtert den Transport von Fragment A ins Zytosol.
Bei der schützenden Immunität handelt es sich um die Antikörperreaktion auf das Diphtherie-Toxin nach klinischer Erkrankung oder auf das Diphtherie-Toxin (durch Formaldehyd inaktiviertes Toxin) nach einer Immunisierung.
Kolonisation
Über die Faktoren, die die Kolonisierung von C. diphtheriae vermitteln, ist wenig bekannt. Es ist jedoch klar, dass neben der Produktion des Diphtherietoxins auch andere Faktoren zur Virulenz beitragen. Epidemiologische Studien haben gezeigt, dass ein bestimmter Lysotyp über lange Zeiträume in einer Population persistieren kann. Später kann er durch einen anderen Lysotyp ersetzt werden. Die Entstehung und anschließende Dominanz eines neuen Lysotyps in einer Population hängt vermutlich mit seiner Fähigkeit zusammen, seinen Abschnitt der nasopharyngealen ökologischen Nische zu kolonisieren und dort effektiv zu konkurrieren. Corynebacterium diphtheriae kann Neuraminidase produzieren, die die Sialinsäure an der Zelloberfläche in ihre Bestandteile Pyruvat und N-Acetylneuraminsäure spaltet. Der Cord-Faktor (6,6'-Di-O-mycoloyl-α, α'-D-Trehalose) ist eine Oberflächenkomponente von C. diphtheriae, seine Rolle bei der Kolonisierung des menschlichen Wirts ist jedoch unklar.
Produktion von Diphtherie-Toxinen
Das Strukturgen des Diphtherie-Toxins, tox, gehört zu einer Familie eng verwandter Corynebakteriophagen, von denen der β-Phage am besten untersucht ist. Die Regulation der Diphtherie-Toxin-Expression erfolgt über einen eisenaktivierten Repressor, DtxR, der im Genom von C. diphtheriae kodiert ist. Die Toxin-Expression hängt vom physiologischen Zustand von C. diphtheriae ab. Unter Bedingungen, unter denen Eisen zum wachstumslimitierenden Substrat wird, dissoziiert Eisen von DtxR, das Toxicodendron-Gen wird aktiviert und Diphtherie-Toxin wird synthetisiert und mit maximaler Geschwindigkeit in das Kulturmedium sezerniert.
Diphtherie-Toxin ist ungewöhnlich wirksam; für empfindliche Spezies (z. B. Menschen, Affen, Kaninchen, Meerschweinchen) sind bereits 100 bis 150 ng/kg Körpergewicht tödlich. Diphtherie-Toxin besteht aus einer einzigen Polypeptidkette mit 535 Aminosäuren. Biochemische, genetische und Röntgenstrukturanalysen zeigen, dass das Toxin aus drei strukturellen/funktionellen Domänen besteht:
- N-terminale ADP-Ribosyltransferase (katalytische Domäne);
- eine Region, die den Transport der katalytischen Domäne durch die Zellmembran erleichtert (Transmembrandomäne);
- eukaryotische Zellrezeptor-Bindungsdomäne.
Nach milder Trypsinverdauung und Reduktion unter denaturierenden Bedingungen kann Diphtherie-Toxin an seiner proteasesensitiven Schleife spezifisch in zwei Polypeptidfragmente (A und B) gespalten werden. Fragment A ist die N-terminale 21 kDa-Komponente des Toxins und enthält die katalytische Stelle für die ADP-Ribosylierung des Elongationsfaktors 2 (EF-2).
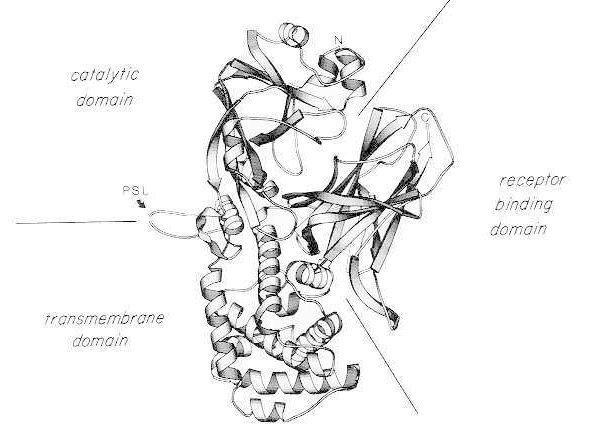
Banddiagramm der Röntgenkristallstruktur des monomeren nativen Diphtherietoxins. (modifiziert nach Bennett MJ, Choe S, Eisenberg D: Domain swapping: Entangling aliances between proteins. Proc Natl Acad Sci, USA, 91: 3127, 1994). Die relativen Positionen der katalytischen, transmembranären und rezeptorbindenden Domänen sind dargestellt. Das intakte Toxin kann durch trypsinähnliche Proteasen an den Positionen Arg190, Arg192 und/oder Arg193, die sich in der Protease-sensitiven Schleife (PSL) befinden, gespalten werden. Nach Reduktion der Disulfidbrücke zwischen Cys186 und Cys201 kann das Toxin in A- und B-Fragmente zerlegt werden. Dargestellt sind der Aminoterminus (N) und der Carboxyterminus (C) des intakten Toxins. Das Banddiagramm wurde mit dem Programm MOLESCRIPT erstellt.
Das C-terminale Fragment, Fragment B, trägt die Transmembran- und Rezeptorbindungsdomänen des Toxins.
Die Vergiftung einer einzelnen eukaryotischen Zelle durch Diphtherietoxin umfasst mindestens vier verschiedene Schritte:
- Bindung des Toxins an seinen Rezeptor auf der Zelloberfläche;
- Ansammlung geladener Rezeptoren in beschichteten Vertiefungen und Internalisierung des Toxins durch rezeptorvermittelte Endozytose; nach Ansäuerung des endozytischen Vesikels durch eine membrangebundene, ATP-getriebene Protonenpumpe,
- Einfügung der Transmembrandomäne in die Membran und erleichterte Abgabe der katalytischen Domäne in das Zytosol, und
- ADP-Ribosylierung von EF-2, was zu einer irreversiblen Unterdrückung der Proteinsynthese führt.
Es wurde gezeigt, dass ein einziges Molekül der katalytischen Domäne, das in das Zytosol abgegeben wird, ausreicht, um für die Zelle tödlich zu sein.
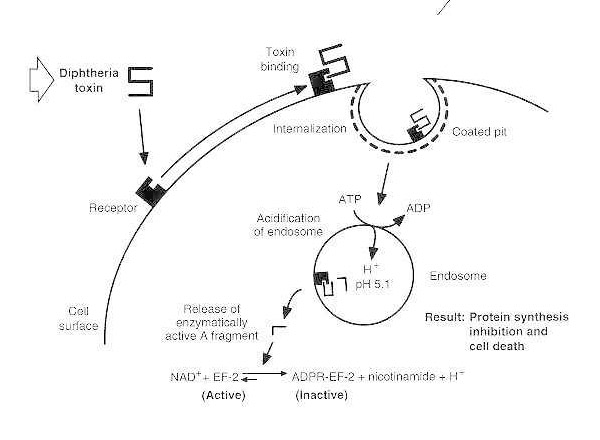
Schematische Darstellung der Diphtherieintoxikation einer anfälligen eukaryotischen Zelle.
Das Toxin bindet an seinen Zelloberflächenrezeptor und wird über eine rezeptorvermittelte Endozytose internalisiert. Bei der Ansäuerung des Endosoms wird die Transmembrandomäne in die Vesikelmembran eingefügt. Die katalytische Domäne wird ins Zytosol abgegeben, was zur Hemmung der Proteinsynthese und zum Zelltod führt.
Epidemiologie
Vor der Massenimpfung der US-Bevölkerung mit Diphtherie-Toxoid war Diphtherie in der Regel eine Kinderkrankheit. Ein bemerkenswerter Aspekt der Massenimpfung mit Diphtherie-Toxoid ist, dass mit zunehmendem Anteil der Bevölkerung mit schützender Antitoxin-Immunität (≥ 0,01 IU/ml) die Häufigkeit der Isolierung toxigener Stämme aus der Bevölkerung abnimmt. Heute ist in den Vereinigten Staaten, wo die klinische Diphtherie fast vollständig verschwunden ist, die Isolierung toxigener Stämme von C. diphtheriae selten. Da eine subklinische Infektion keine Kontaktquelle mehr mit dem Diphtherie-Antigen darstellt und die Immunität gegen das Antitoxin ohne Auffrischung nachlässt, hat ein großer Prozentsatz der Erwachsenen (30 bis 60 %) einen Antitoxinspiegel unterhalb des schützenden Niveaus und ist gefährdet. In den Vereinigten Staaten, Europa und Osteuropa traten die jüngsten Diphtherie-Ausbrüche hauptsächlich bei Personen auf, die Alkohol- und/oder Drogenmissbrauch betreiben. Innerhalb dieser Gruppe verfügen Träger des toxinbildenden C. diphtheriae über eine mäßig hohe antitoxische Immunität. Der jüngste Zusammenbruch der öffentlichen Gesundheitsmaßnahmen in Russland hat dazu geführt, dass sich Diphtherie zu einer Epidemie entwickelt hat. Bis Ende 1994 wurden in Russland über 80.000 Fälle und über 2.000 Todesfälle gemeldet.
Herdartige Diphtherieausbrüche stehen fast immer im Zusammenhang mit einem Immunträger, der aus einer Region zurückgekehrt ist, in der Diphtherie endemisch ist. Tatsächlich wurden jüngste Ausbrüche klinischer Diphtherie in den USA und Europa mit Reisenden in Verbindung gebracht, die aus Russland und Osteuropa zurückkehrten. Toxigene Stämme von C. diphtheriae werden direkt von Mensch zu Mensch durch Tröpfcheninfektion übertragen. Es ist bekannt, dass toxigene Stämme den Nasen-Rachen-Raum direkt besiedeln können. Darüber hinaus kann das toxigene Gen indirekt durch die Freisetzung toxigener Corynebakteriophagen und die lysogene Transformation nichttoxigener autochthoner C. diphtheriae in situ verbreitet werden. [ 5 ]
Neben der Bestimmung des Biotyps und Lysotyps von C. diphtheriae-Isolaten können heute auch molekularbiologische Techniken zur Untersuchung von Diphtherieausbrüchen eingesetzt werden. Restriktionsendonuklease-Verdauungsmuster der chromosomalen DNA von C. diphtheriae wurden zur Untersuchung klinischer Ausbrüche herangezogen, ebenso wie die Verwendung geklonter corynebakterieller Insertionssequenzen als genetische Sonde.
Der Schick-Test wird seit vielen Jahren verwendet, um die Immunität gegen Diphtherie-Toxin zu beurteilen, obwohl er mittlerweile in vielen Bereichen durch den serologischen Test auf spezifische Antikörper gegen Diphtherie-Toxin ersetzt wurde. Beim Schick-Test wird eine kleine Menge Diphtherie-Toxin (etwa 0,8 ng in 0,2 ml) intradermal in den Unterarm (Teststelle) und 0,0124 μg Diphtherie-Toxin in 0,2 ml intradermal in die Kontrollstelle injiziert. Die Messungen werden nach 48 und 96 Stunden durchgeführt. Unspezifische Hautreaktionen erreichen normalerweise nach 48 Stunden ihren Höhepunkt. Nach 96 Stunden weist eine erythematöse Reaktion mit möglicher Nekrose an der Teststelle auf eine unzureichende antitoxische Immunität hin, um das Toxin zu neutralisieren (≤ 0,03 IU/ml). Eine Entzündung sowohl im Test- als auch im Kontrollbereich nach 48 Stunden weist auf eine Überempfindlichkeitsreaktion auf das Antigenpräparat hin.
Formen
Corynebacterium diphtheriae infiziert den Nasenrachenraum oder die Haut. Toxigene Stämme produzieren ein starkes Exotoxin, das Diphtherie auslösen kann. Zu den Symptomen der Diphtherie gehören Rachenentzündung, Fieber und Schwellungen im Halsbereich oder im Bereich der Hautläsion. Diphtherie-Läsionen sind von einer Pseudomembran bedeckt. Das Toxin breitet sich über die Blutbahn in entfernte Organe aus und kann Lähmungen und Herzinsuffizienz verursachen. [ 6 ]
Es gibt zwei klinische Formen der Diphtherie: die nasopharyngeale und die kutane Diphtherie. Die Symptome der pharyngealen Diphtherie reichen von leichter Pharyngitis bis hin zu Hypoxie aufgrund einer Atemwegsobstruktion durch eine Pseudomembran. Eine Beteiligung der Halslymphknoten kann zu einer starken Halsschwellung (Stierhalsdiphtherie) führen, und der Patient kann Fieber (≥ 39 °C) entwickeln. Hautläsionen bei kutaner Diphtherie sind meist von einer graubraunen Pseudomembran bedeckt. Lebensbedrohliche systemische Komplikationen, vor allem Verlust der motorischen Funktion (z. B. Schluckbeschwerden) und Herzinsuffizienz, können sich durch die Einwirkung des Diphtherietoxins auf periphere Motoneuronen und das Myokard entwickeln.
Kontrolle
Die Kontrolle der Diphtherie hängt von einer ausreichenden Immunisierung mit Diphtherie-Toxoid ab: Diphtherie-Toxin, das durch Formaldehyd inaktiviert wird und antigenisch intakt bleibt. Das Toxoid wird durch Inkubation von Diphtherie-Toxin mit Formaldehyd bei 37 °C unter alkalischen Bedingungen hergestellt. Die Diphtherie-Immunisierung sollte im zweiten Lebensmonat mit einer Serie von drei Grundimpfungen im Abstand von 4 bis 8 Wochen beginnen, gefolgt von einer vierten Dosis etwa ein Jahr nach der letzten Grundimpfung. Diphtherie-Toxoid wird häufig als Bestandteil des Diphtherie-Pertussis-Tetanus-Impfstoffs (DPT) verwendet. Epidemiologische Studien haben gezeigt, dass die Immunisierung gegen Diphtherie zu etwa 97 % wirksam ist. Obwohl in den USA und Europa Massenimpfungen gegen Diphtherie durchgeführt werden und die Durchimpfungsraten bei Kindern ausreichend sind, kann ein großer Teil der erwachsenen Bevölkerung Antikörpertiter unterhalb des schützenden Niveaus aufweisen. Erwachsene sollten alle 10 Jahre mit Diphtherie-Toxoid aufgefrischt werden. Tatsächlich sollten Reisende in Gebiete mit hoher endemischem Diphtherierate (Mittel- und Südamerika, Afrika, Asien, Russland und Osteuropa) eine Auffrischungsimpfung mit Diphtherie-Tetanus-Toxoid erhalten. In den letzten Jahren konnten durch die Verwendung hochreiner Toxoidpräparate zur Immunisierung gelegentlich auftretende schwere Überempfindlichkeitsreaktionen minimiert werden. Reisende in Gebiete mit hoher endemischem Diphtherierate (Mittel- und Südamerika, Afrika, Asien, Russland und Osteuropa) sollten eine Auffrischungsimpfung mit Diphtherie-Tetanus-Toxoid erhalten. In den letzten Jahren konnten durch die Verwendung hochreiner Toxoidpräparate zur Immunisierung gelegentlich auftretende schwere Überempfindlichkeitsreaktionen minimiert werden. Reisende in Gebiete mit hoher endemischem Diphtherierate (Mittel- und Südamerika, Afrika, Asien, Russland und Osteuropa) sollten eine Auffrischungsimpfung mit Diphtherie-Tetanus-Toxoid erhalten. In den letzten Jahren konnten durch die Verwendung hochreiner Toxoidpräparate zur Immunisierung gelegentlich auftretende schwere Überempfindlichkeitsreaktionen minimiert werden.
Obwohl Antibiotika (wie Penicillin und Erythromycin) zur Behandlung von Diphtheriepatienten eingesetzt werden, ist eine schnelle passive Immunisierung mit Diphtherie-Antitoxin am wirksamsten, um die Letalität zu senken. Die lange Halbwertszeit des spezifischen Antitoxins im Blut ist ein wichtiger Faktor für die effektive Neutralisierung des Diphtherie-Toxins. Um jedoch wirksam zu sein, muss das Antitoxin mit dem Toxin reagieren, bevor es in die Zelle gelangen kann.
Reengineering des Diphtherietoxins zur Entwicklung eukaryotischer rezeptorspezifischer Zytotoxine
Protein-Engineering ist ein neues und sich rasch entwickelndes Gebiet der Molekularbiologie. Es kombiniert rekombinante DNA-Methoden und Festphasen-DNA-Synthese zur Entwicklung und Konstruktion chimärer Gene mit einzigartigen Eigenschaften. Untersuchungen der Struktur-Funktions-Beziehungen des Diphtherietoxins haben eindeutig gezeigt, dass dieses Toxin ein Protein mit drei Domänen ist: katalytisch, transmembranär und rezeptorisch. Es war möglich, die native Rezeptorbindungsdomäne des Diphtherietoxins genetisch durch verschiedene Polypeptidhormone und Zytokine (z. B. α-Melanozyten-stimulierendes Hormon [α-MSH], Interleukin (IL) 2, IL-4, IL-6, IL-7, epidermaler Wachstumsfaktor) zu ersetzen. Die resultierenden chimären Proteine oder Fusionstoxine kombinieren die Rezeptorbindungsspezifität des Zytokins mit den transmembranären und katalytischen Domänen des Toxins. In jedem Fall wurde gezeigt, dass die Fusionstoxine selektiv nur diejenigen Zellen vergiften, die den entsprechenden Zielrezeptor tragen. Das erste dieser genetisch modifizierten Fusionstoxine, DAB 389IL-2, wird derzeit in klinischen Studien am Menschen zur Behandlung von refraktären Lymphomen und Autoimmunerkrankungen erprobt, bei denen Zellen mit hochaffinen IL-2-Rezeptoren eine wichtige Rolle in der Pathogenese spielen.[ 7 ] Die Verabreichung von DAB 389 IL-2 erwies sich als sicher, gut verträglich und in der Lage, eine dauerhafte Remission der Krankheit ohne schwerwiegende Nebenwirkungen zu induzieren. Es ist wahrscheinlich, dass sich Diphtherietoxin-basierte Fusionstoxine zu wichtigen neuen biologischen Wirkstoffen für die Behandlung spezifischer Tumoren oder Erkrankungen entwickeln werden, bei denen spezifische Zelloberflächenrezeptoren gezielt angesteuert werden können.


 [
[